层析试纸条、检测试剂盒及方法与流程-j9九游会真人
1.本发明涉及免疫检测技术领域,特别是涉及一种层析试纸条、检测试剂盒及方法。
背景技术:
2.传统免疫层析试纸条是免疫学与薄层层析技术的结合,传统免疫层析试纸条的结构主要包括五个部分:加样区(样品垫)、标记区(结合垫)、显示区(层析膜)、吸水区(吸水垫)和底板。样品垫主要用于加样;结合垫主要用于装载标记物(例如胶体金标记的单抗或二抗或者抗原)并在层析检测中稳定地释放这些标记物;层析膜的主要作用是固化抗原或者抗体等并提供层析检测反应的场所,在免疫层析实验中主要用点样仪在膜上线状固化抗原或抗体等形成检测线(t线)和/或质控线(c线);吸水垫是层析反应的动力源,控制着层析反应中待检样品持续流动的方向;底板用于为免疫层析试纸条的层叠结构提供刚性支持。
3.多种免疫学反应形式都可以应用于免疫层析试纸条上,例如常见的双抗体夹心法、双抗原夹心法、间接法、捕获法等等。基于夹心法的层析试纸条是利用了检测线上固化的捕获抗体或者抗原对待检样中的分析物进行捕获固定,同时标记抗体或者抗原与分析物结合,由此检测线上形成带标记的夹心结构复合物,通过标记呈现可检测/可视的信号。具体地,基于间接法的层析试纸条是利用了检测线上固化的抗原对待检样中的分析物(抗体)进行捕获固定,同时标记二抗(抗抗体)与分析物结合,由此检测线上形成带标记的夹心结构复合物,通过标记呈现可检测/可视的信号;而捕获法是将二抗固化,抗原作为标记端,形成二抗-待测抗体-抗原-标记物的免疫复合物形式,以呈现信号。
4.在使用基于夹心法的层析试纸条时,将待检样品(例如血清、尿液等)加入样品垫,如果待检样中有分析物,则与结合垫中的标记剂反应形成复合物,复合物在毛细作用下通过层析膜向吸水垫方向流动,并被层析膜上固化的相应的抗原或抗体等配体分子捕获(捕获位置在检测线上),从而能肉眼看到或者通过能识别标记物信号的设备检测到。
5.除了免疫层析外,化学发光和酶联免疫也可以承载多种免疫学反应形式;与免疫层析不同的是固相的形式通常采用例如磁珠或者微孔板;标记物通常采用例如辣根过氧化物酶、碱性磷酸酶、吖啶酯等等。
6.以上这些检测方法及模式的灵敏度还有改善的空间。
技术实现要素:
7.基于此,有必要提供一种层析试纸条,该试纸条具有改善的灵敏度。
8.同时还提供一种可改善灵敏度的检测试剂、检测试剂盒及免疫检测方法。
9.一种层析试纸条,所述层析试纸条包括底板和位于底板上的样品垫、结合垫、层析膜和吸水垫,所述结合垫上设置有经标记物标记的标记剂,所述经标记物标记的标记剂能与分析物、及连接有生物素和/或生物素衍生物的捕获剂形成复合物,所述层析膜上设置有t线,所述t线上设置有多聚链霉亲和素。
10.上述层析试纸条利用连接有生物素和/生物素衍生物的捕获剂捕获待测样本中的
分析物,结合垫上的经标记物标记的标记剂能够与捕获了分析物的捕获剂结合而形成复合物,再利用生物素和/生物素衍生物与多聚链霉亲和素的特异性结合而在t线上富集复合物,相比采用普通的链霉亲和素模式,提高了检测的灵敏度。
11.在其中一个实施例中,所述连接有生物素和/或生物衍生物的捕获剂设置在所述样品垫上。
12.在其中一个实施例中,所述标记物包括发色团、地高辛标记探针、电子致密物质、金属粒子和产生可检测信号的酶中的至少一种。
13.在其中一个实施例中,所述多聚链霉亲和素的分子量在150kda以上。
14.在其中一个实施例中,所述多聚链霉亲和素的分子量为150kda~1340kda。
15.在其中一个实施例中,所述分析物为抗体、抗原、配体、受体、寡核苷酸、半抗原、表位、模拟表位或适体。
16.在其中一个实施例中,所述分析物为sars-cov-2、sars-cov-2的n蛋白、sars-cov-2抗体、c-反应蛋白、血清淀粉样蛋白a、降钙素原、白细胞介素6、尿微量白蛋白、β2-微球蛋白、视黄醇结合蛋白、胱抑素c、人中性粒细胞明胶酶相关脂质运载蛋白、d-二聚体、肌钙蛋白i、肌钙蛋白t、n末端脑钠肽、n-末端脑钠肽前体、脑尿钠肽、肌酸激酶同工酶或肌红蛋白中的一种。
17.在其中一个实施例中,所述层析试纸条基于夹心法。
18.一种检测试剂,包括固相载体和包被在所述固相载体上的多聚链霉亲和素。
19.在其中一个实施例中,所述多聚链霉亲和素的分子量在150kda以上。
20.在其中一个实施例中,所述固相载体包括管、板、膜和微球中的至少一种。
21.在其中一个实施例中,所述多聚链霉亲和素的分子量为150kda~1340kda。
22.一种检测试剂盒,包括上述的检测试剂;
23.在其中一个实施例中,所述检测试剂盒还包括连接有生物素和/或生物素衍生物的捕获剂;和/或,所述检测试剂盒还包括经标记物标记的标记剂。
24.在其中一个实施例中,所述检测试剂盒的分析物为抗体、抗原、配体、受体、寡核苷酸、半抗原、表位、模拟表位或适体。
25.在其中一个实施例中,所述标记物包括发色团、地高辛标记探针、电子致密物质、金属粒子和产生可检测信号的酶中的至少一种。
26.一种层析试剂盒,包括:
27.捕获剂,所述捕获剂连接有生物素和/或生物素衍生物;及
28.上述的层析试纸条。
29.一种免疫检测方法,所述检测方法利用包被在固相载体上的多聚链霉亲和素结合分析物与标记剂和捕获剂形成的复合物而实现检测,所述捕获剂为连接有生物素和/或生物素衍生物的捕获剂。
30.在其中一个实施例中,所述多聚链霉亲和素的分子量在150kda以上。
31.在其中一个实施例中,所述多聚链霉亲和素的分子量为150kda~1340kda。
32.在其中一个实施例中,所述固相载体包括管、板、膜和微球中的至少一种。
33.在其中一个实施例中,所述标记剂为经标记物标记的标记剂。
附图说明
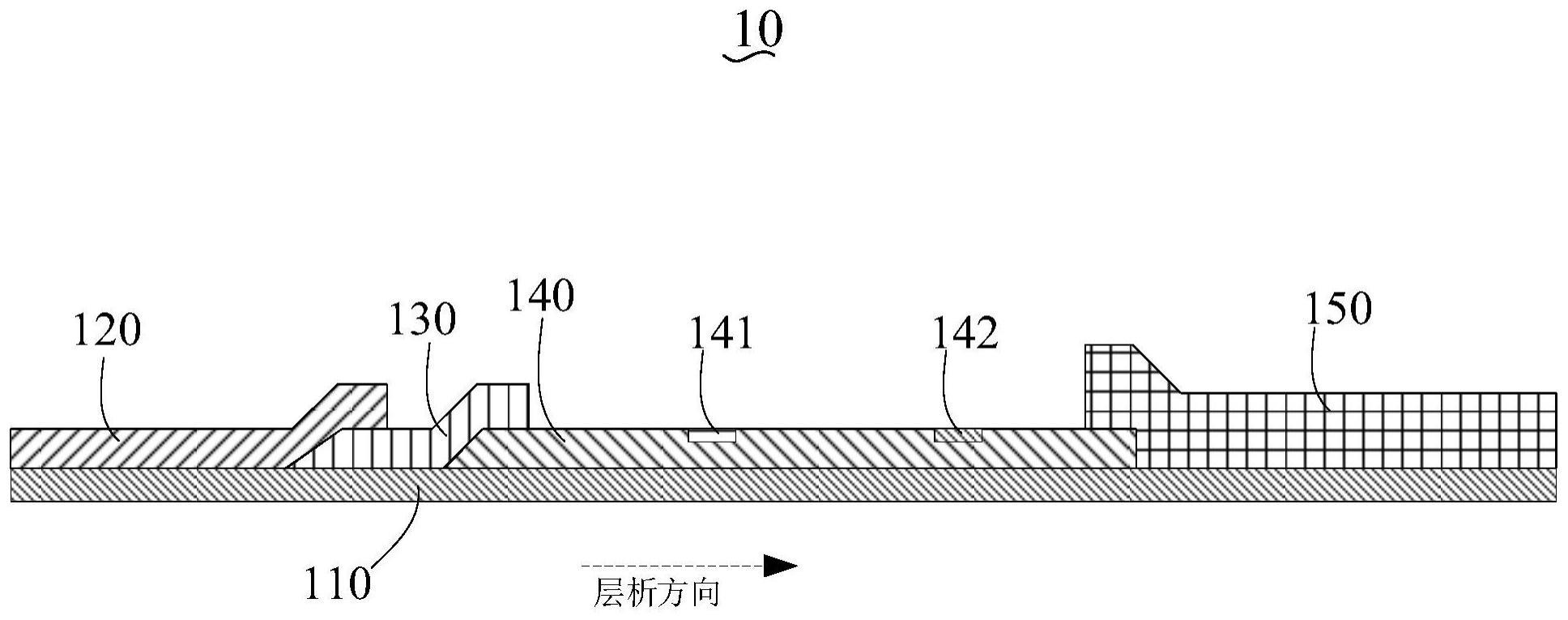
34.图1为一实施方式的层析试纸条的示意图;
35.图2为实施例1中的sec图谱;
36.图3为实施例2中的表1中的试纸条的标准曲线。
37.附图标记;
38.10、层析试纸条;110、底板;120、样品垫;130、结合垫;140、层析膜;150、吸水垫;141、t线;142、c线。
具体实施方式
39.为了便于理解本发明,下面将对本发明进行更全面的描述,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使本发明公开内容更加透彻全面。
40.需要说明的是,术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
41.术语“抗体”指能特异性结合于相应抗原的免疫球蛋白分子的蛋白质或多肽。抗体可为多克隆或单克隆、多链或单链或完整免疫球蛋白,可来源于天然来源或重组来源。例如,天然存在的igg抗体是包含通过二硫键相互连接的至少两条重(h)链及两条轻(l)链的四聚体。各重链由重链可变区(vh)及重链恒定区构成。重链恒定区由三个结构域(ch1、ch2及ch3)构成。各轻链由轻链可变区(vl)及轻链恒定区构成。轻链恒定区由一个结构域(cl)构成。vh及vl区可进一步细分成称为互补决定区(cdr)的高变区,分散在称为框架区(fr)的较保守区中。各vh及vl由自氨基端至羧基端按以下顺序排列的三个cdr及四个fr组成:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。重链及轻链的可变区含有与抗原相互作用的结合结构域。抗体的恒定区可介导免疫球蛋白与宿主组织或因子(包括免疫系统的各种细胞(例如效应细胞)及经典补体系统的第一组分(c1q))的结合。“抗体”包括但不限于单克隆抗体、人抗体、人源化抗体、嵌合抗体和抗独特型(抗id)抗体。抗体可以属于任何同种型/类别(例如igg、ige、igm、igd、iga及igy)或亚类(例如igg1、igg2、igg3、igg4、iga1及iga2)。
42.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
43.请参阅图1,本技术一实施方式提供了一种层析试纸条10,用于检测待测样品中的分析物,该层析试纸条10包括底板110和位于底板110上的样品垫120、结合垫130、层析膜140和吸水垫150。结合垫130上设置有经标记物标记的标记剂,经标记物标记的标记剂能与分析物、及连接有生物素和/或生物素衍生物的捕获剂形成复合物,层析膜140上设置有t线141和c线142,t线141上设置有多聚链霉亲和素。
44.生物素(biotin,b)广泛分布于动、植物组织中,常从含量较高的卵黄和肝组织中提取。生物素的分子量244.31da。生物素分子有两个环状结构,其中ⅰ环为咪唑酮环,是与亲和素结合的主要部位;ii环为噻吩环,c2上有一戊酸侧链,其末端羧基是结合抗体和其他生物大分子的唯一结构,经化学修饰后,生物素可成为带有多种活性基团的衍生物—活化生物素。活化生物素可以在蛋白质交联剂的介导下,与已知的几乎所有生物大分子偶联,包括
蛋白质、核酸、多糖、脂类等。
45.链霉亲和素(streptavidin,sa)是由链霉菌分泌的一种蛋白质,分子量为50kda~70kda。链霉亲和素不含半胱氨酸残基、碳水化合物侧链或相关辅助因子。链霉亲和素是由4条相同的肽链组成的同源四聚体,每条肽链由159个氨基酸组成,每条肽链都能结合一个生物素。也即是一个链霉亲和素分子能结合4个生物素分子。链霉亲和素与生物素的亲和常数(k)约为10-15
mol/l。
46.以常规的免疫层析为例,标记复合物(即经标记物标记的标记剂与分析物形成的复合物,下同)与固定在t线上的抗原或抗体发生反应时,由于反应时间较短,有大量的标记复合物无法与t线上的抗原或抗体结合,从而使得检测试纸的灵敏度受到了损失。而在应用亲和素-生物素放大系统中,例如将标记物-链霉亲和素-生物素连接在抗原或抗体上,在连接有标记物-链霉亲和素-生物素的抗原或抗体与分析物及另一个固定在t线上的抗原或抗体形成复合物后,肉眼或检测标记物的量而实现检测,但连接有标记物-链霉亲和素-生物素的抗原或抗体由于空间位阻,其与分析物的结合效率也受到的影响,从而灵敏度改善不佳。又例如还可以将链霉亲和素固定在t线上,去捕获形成的生物素-抗体-待测抗原-抗体-标记物的复合物,但是研究发现这种模式下生物素与链霉亲和素的结合效率受到影响,并没有起真正的放大效果。
47.而本技术的上述层析试纸条10通过在用于捕获分析物的捕获剂上连接生物素和/生物素衍生物,在用于与捕获了分析物的捕获剂结合的标记剂上标记有标记物,并将标记有标记物的标记剂设置在结合垫130上,从而使得标记剂、分析物和捕获剂所形成的复合物在结合垫130上形成复合物,然后在毛细作用力的继续作用下移动至t线141上并与设置在t线141上的多聚链霉素结合,从而通过t线141上富集的标记物对分析物进行定量和/或定性判断。上述层析试纸条利用了多聚sa包膜,增加链霉亲和素的分子量,使得充分暴露sa与生物素的结合位点,使更多的复合物能够结合到链霉亲和素上,起到真正的放大效果,从而提高了检测的灵敏度。
48.具体地,样品垫120用于加样。样品垫120的材质没有特别限制。在一些实施例中,样品垫120为过滤性介质。过滤性介质可以过滤样本中的颗粒、调节样本的ph以及结合样本中干扰随后层析反应的成分。在一个可选地具体示例中,样品垫120的材质为纤维素、玻璃纤维或人造纤维。
49.具体地,连接有生物素和/或生物素衍生物的捕获剂用于捕获分析物,并在与分析物形成复合物后通过其上的生物素和/或生物衍生物与t线141上的多聚链霉素特异性结合。需要说明的是,本文中的生物素衍生物是与生物素同功能的衍生物,其能与链霉亲和素特异性结合。可选地,生物素衍生物选自d-生物素、活化生物素、生物胞素、乙二胺生物素、尸胺生物素或脱硫生物素。
50.在一些实施例中,连接有生物素和/或生物衍生物的捕获剂设置在样品垫120上。可以理解的是,在另一些实施例中,连接有生物素和/或生物衍生物的捕获剂还可以不设置在样品垫120上。例如,在一些实施例中,所述连接有生物素和/或生物素衍生物的捕获剂独立设置于层析试纸条外。在使用时,将待测样本与连接有生物素和/或生物衍生物的捕获剂混合后加到样品垫120上。
51.在一些实施例中,样品垫120上还可以选择性包被阻断剂。阻断剂用于去除内源性
干扰,可以结合待测样本中存在干扰的物质。一般可以选取本领域商业化的阻断剂,例如对hama和类风湿因子有效的阻断剂。
52.具体地,结合垫130用于装载经标记物标记的标记剂,并能使经标记物标记的标记剂在层析检测中稳定释放。在一些实施例中,结合垫130的材质为玻璃纤维、聚酯纤维或者人造纤维。可以理解的是,结合垫130的材质没有特别限制。
53.本文中,标记物是指能够提供被检测的信号的物质。在一些实施例中,标记物选自发色团、地高辛标记探针、电子致密物质、金属粒子及产生可检测信号的酶中的至少一种。可选地,发色团选自荧光、量子点、荧光微球、发光化合物和染料中的一种或多种。在一些实施例中,发色团为发光化合物。例如,吖啶酯、吖啶酯衍生物、金刚烷、鲁米诺、异鲁米诺等。可选地,吖啶酯衍生物选自吖啶酯磺酰胺、吖啶酯甲苯磺酰胺、吖啶酯对甲基磺酰胺及吖啶酯三氟甲基磺酰胺中的至少一种。电子致密物质为放射性分子。例如
32
p,
35
s或
125
i。在一些实施例中,产生可检测信号的酶选自辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶和葡萄糖-6-磷酸脱氢酶中的一种。在一些实施例中,金属粒子是胶体金属,例如胶体金、胶体银、胶体硒等。可以理解的是,标记物不限于上述,还可以是其他能够被肉眼直接观察到、借助仪器检测到的具有颜色的物质。
54.在一些实施例中,标记物直接与标记剂连接。
55.在另一些实施例中,标记物通过桥接物间接与标记剂连接。可选地,桥接物选自蛋白、蛋白复合物或双功能交联剂中的一种或多种。在其中一个实施例中,作为桥接物的蛋白中含有牛血清白蛋白、卵白蛋白、钥孔血蓝蛋白、免疫球蛋白、甲状腺球蛋白或多聚赖氨酸。作为桥接物的蛋白复合物中含有牛血清白蛋白、卵白蛋白、钥孔血蓝蛋白、免疫球蛋白、甲状腺球蛋白和多聚赖氨酸中的至少两种。在一个可选地具体实施例中,桥接物为牛血清白蛋白。牛血清白蛋白本身具有一定的降低非特异性信号的作用,可以增加实验的信噪比。可选地,双功能交联剂选自4-(4-n-马来酰亚胺基苯基)丁酸酰肼(4-[4-n-maleimidophenyl]butyric acid hydrazide hydrochloride,mpbh)、1-[2-[2-(2-氨基乙氧基)乙氧基]乙基]马来酰亚胺盐酸盐(1-[2-[2-(2-aminoethoxy)ethoxy]ethyl]maleimide hydrochloride,mpeg2a)、n-[β-马来酰亚胺丙酸]酰肼,三氟乙酸盐(n-[β-maleimidopropionic acid]hydrazide,trifluoroacetic acid salt,bmph)、n-[ε-马来酰亚胺基己酸)酰肼,三氟乙酸盐(n-[ε-maleimidocaproic acid)hydrazide,trifluoroacetic acid salt,emch)、n-[κ-马来酰亚胺十一烷酸]酰肼,三氟乙酸盐(n-[κ-maleimidoundecanoic acid]hydrazide,trifluoroacetic acid salt,kmuh)中的任一种。可以理解的是,在一些实施例中,桥接物具有放大信号的作用。例如,桥接物可以偶联更多的标记物以放大信号。
[0056]
具体地,分析物是上述层析试纸条10检测的目标物。分析物是同时能与捕获剂和标记剂特异性结合的物质。分析物与捕获剂和标记剂以结合对的形式呈现。例如受体/配体对、抗体/抗原、天然或合成受体/配体对、半抗原/抗体对、抗原/抗体对、表位/抗体对、模拟位/抗体对、适体/靶分子对、杂交伴侣、和嵌入物/靶分子对。例如,在一些实施例中,分析物为寡核苷酸序列、适体、适体配体、抗体、抗原、配体、受体、半抗原、表位、或模拟位,则相应的捕获剂和标记剂分别包含互补的寡核苷酸序列、适体配体、适体、抗原、抗体、受体、配体、或抗体。在一个可选地具体示例中,分析物为抗原,捕获剂和标记剂为特异性结合该抗原的抗体。当然,在基于夹心法的免疫检测中,捕获剂与分析物的结合位点与标记剂和分析物的
结合位点不同。可选地,分析物为sars-cov-2、sars-cov-2的n蛋白、sars-cov-2抗体、c-反应蛋白、血清淀粉样蛋白a、降钙素原、白细胞介素6、尿微量白蛋白、β2-微球蛋白、视黄醇结合蛋白、胱抑素c、人中性粒细胞明胶酶相关脂质运载蛋白、d-二聚体、肌钙蛋白i(例如心肌肌钙蛋白i)、肌钙蛋白t、n末端脑钠肽、n-末端脑钠肽前体、脑尿钠肽、肌酸激酶同工酶或肌红蛋白。
[0057]
具体地,层析膜140主要作用是固定多聚链霉亲和素。在免疫层析实验中主要用接触式或非接触式点样仪在膜上线状固化多聚链霉亲和素形成检测线(t线141),在一些实施例中,所述层析膜上设有质控线(c线142),在一些实施例中,在层析膜上还线状固化抗原或抗体形成质控线(c线142)。
[0058]
在一些实施例中,层析膜140为硝酸纤维素膜。
[0059]
多聚链霉亲和素用于结合分析物与捕获剂和标记剂形成的复合物。在本文中,多聚链霉亲和素是指由至少两个链霉亲和素聚合而成的物质。在一些实施例中,多聚链霉亲和素的分子量在150kda以上。进一步地,多聚链霉亲和素的分子量为150kda~1340kda。需要说明的还是,术语“以上”在表示数值范围时,包括本数。
[0060]
在一些实施例中,多聚链霉亲和素通过链霉亲和素的氨基和羧基发生缩合反应形成酰胺键而聚合。可选地,将用于活化羧基的活化剂与链霉亲和素混合反应,制备多聚链霉亲和素。活化剂包括碳二亚胺。在一个可选地具体示例中,活化剂为二环已基碳二亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺(edc)和n,n
′‑
二异丙基碳二亚胺中的至少一种。在一些实施例中,活化剂还包括n-羟基琥珀酰亚胺(nhs)和n-羟基磺基琥珀酰亚胺(sulfo-nhs)中的至少一种。通过n-羟基琥珀酰亚胺和/或n-羟基磺基琥珀酰亚胺,增加反应效率。可以理解的是,多聚链霉亲和素的制备方法不限于上述,还可以是其他方法。
[0061]
在一些实施例中,结合垫130上还包被有标记物标记的质控品;c线142上包被有能与质控品特异性结合的物质。可选地,质控品为带有标记物的二抗;c线142上包被有一抗。标记物如上文所述。在一个可选地具体示例中,质控品为羊抗鸡igy-荧光微球,c线142上包被有鸡igy。可以理解的是,质控品和c线142上包被的物质不限于上述。
[0062]
具体地,吸水垫150是层析反应的动力源,控制着层析反应中待检样品持续流动的方向。吸水垫150的材质一般为高密度的纤维素。
[0063]
具体地,底板110用于为层析试纸条10的层叠结构提供刚性支持。可选地,底板110的材料为聚苯乙烯或者其他塑料材料。
[0064]
在一些实施例中,所述层析试纸条基于夹心法。本领域可以理解的是,还可以是基于间接法、捕获法等等,都是可以利用多聚sa实现相应的效果。
[0065]
基于上述,本技术一实施方式还提供一种检测试剂,该检测试剂包括固相载体和包被在固相载体上的多聚链霉亲和素。上述检测试剂可以作为检测试剂盒的组分,利用包被有多聚链霉亲和素的固相载体捕获分析物与标记剂和分析物及捕获剂形成的复合物,从而实现检测。
[0066]
具体地,多聚链霉亲和素如上文描述。
[0067]
在一些实施例中,固相载体包括管、板、膜或微球中的至少一种,例如ep管、多孔板等。
[0068]
在其中一个实施例中,多孔板为酶标板。在一个可选地具体示例中,多孔板的孔位
为16、32、48、64、96或更多。
[0069]
在本文中,术语“微球”可以为球体、近球体、立方体、多面体或不规则形状。在一些实施例中,微球的直径为10nm~1mm。在一个可选地具体示例中,微球的直径为100nm、500nm、1μm、10μm、100μm或500μm。进一步地,微球的直径为400nm~10μm。在一些实施例中,微球为磁珠,其成分中含有磁性物质。磁性物质可以为金属(金属单质或合金)、非金属,或金属与非金属所形成的复合物。金属例如铁、铝镍钴金属等;非金属例如铁氧体非金属(例如fe2o3或fe3o4磁性纳米粒子);金属与非金属所形成的复合物例如钕铁硼橡胶磁复合材料。在一些实施例中,微球的表面修饰有一种或多种活性功能基团。可选地,活性功能基团包括-oh、-cooh、-nh2、-cho及-so3h中的一种或多种。在一些实施例中,包被的多聚链霉亲和素通过物理吸附或直接化学缀合(例如通过桥接物进行桥接)与微球缀合或结合。在一些实施例中,固相载体的材质为聚苯乙烯、塑料、纤维素、聚丙烯酰胺、聚乙烯聚丙烯、交联葡聚糖、玻璃、硅橡胶和琼脂糖凝胶中的一种或多种。
[0070]
基于上述,本技术一实施方式还提供了一种检测试剂盒,该试剂盒包括以上所述的检测试剂。
[0071]
在一些实施方式中,所述检测试剂盒还包括连接有生物素和/或生物素衍生物的捕获剂;具体地,捕获剂和检测试剂如上文所述。该试剂盒在使用时,通过捕获剂、检测试剂及标记剂的配合而实现分析物的定性或定量检测。
[0072]
在一些实施例中,所述检测试剂盒还包括标记剂。具体地,标记剂具体如上文描述。可以理解的是,在其他实施例中,标记剂也可以省略。在不含标记剂的试剂盒使用时,配合另外的标记剂(例如另外购得的)使用即可。
[0073]
在一些实施方式中,所述分析物、标记物如上文描述。
[0074]
基于上述,本技术一实施方式还提供了一种层析试剂盒,该层析试剂盒包括捕获剂和层析试纸条。具体地,捕获剂如上文免疫层析试剂的描述,此处不再描述。层析试剂盒中的层析试纸条与上文的层析试纸条大致相同,即层析试剂盒中的层析试纸条也包括底板和位于底板上的样品垫、结合垫、层析膜和吸水垫,结合垫上设置有经标记物标记的标记剂,经标记物标记的标记剂用于与分析物、及连接有生物素和/或生物素衍生物的捕获剂形成复合物,层析膜上设置有t线,t线上设置有多聚链霉亲和素,多聚链霉亲和素用于结合复合物。其不同在于,层析试剂盒中的层析试纸条的样品垫上没有捕获剂。在使用时,将捕获剂与待测样品混合之后加到样品垫上。通过将捕获剂独立于层析试纸条的设置,可以使得捕获剂与待测样品混合更均匀,使得捕获剂与待测样品中的分析物结合更充分,减少由于层析速度快而引起的捕获剂与分析物结合较少而影响检测灵敏度。
[0075]
在一些实施例中,上述层析试剂盒还包括阻断剂。在一些实施例中,阻断剂独立于层析试纸条。在使用时,将阻断剂与待测样本混合之后加到层析试纸条的样品垫上。在另一些实施例中,阻断剂包被在层析试纸条的样品垫上。当然,阻断剂的组成如上文的层析试纸条处的描述。
[0076]
上述的层析试剂盒的层析试纸条与上述的免疫层析试剂条大致相同,均是通过将多聚链霉亲和素设置在t线上进行检测,具有上述的免疫层析试剂条相同的优点。
[0077]
此外,本技术一实施方式还提供了一种免疫检测方法,该检测方法利用包被在固相载体上的多聚链霉亲和素结合分析物与标记剂和捕获剂形成的复合物而实现检测,其中
所述捕获剂为连接有生物素和/或生物素衍生物的捕获剂。可选地,上述检测方法利用双抗体夹心法、双抗原夹心法、间接法或捕获法实现待测样品中分析物的检测。可以理解的是,此处的固相载体可以是上文检测试剂处描述的固相载体,也可以是上文层析试纸条中的层析膜。此处的多聚链霉亲和素、捕获剂、标记剂、分析物、标记物可以如上文所述。
[0078]
在一些实施例中,该检测方法包括步骤:将待测样品、捕获剂、标记剂和包被有多聚链霉亲和素的固相载体混合后,检测固相载体上形成的复合物的信号而确定待测样品中分析物的量。
[0079]
在一些实施例中,该检测方法通过采用上述任一项实施例的层析试纸条而实现检测。可选地,上述检测方法的步骤包括:将待测样品滴加到上述任一实施例的层析试纸条的样品垫上后,观察或检测t线上的信号,从而确定待测样品中分析物的量。
[0080]
具体实施例
[0081]
以下结合具体实施例进行详细说明。以下实施例如未特殊说明,则不包括除不可避免的杂质外的其他组分。实施例中采用试剂和仪器如非特别说明,均为本领域常规选择。实施例中未注明具体条件的实验方法,按照常规条件,例如文献、书本中所述的条件或者生产厂家推荐的方法实现。
[0082]
实施例1
[0083]
多聚链霉亲和素(多聚sa)的制备
[0084]
将10mg/ml的链霉亲和素(sa)与20mg/ml的edc按体积1:1进行充分混匀,反应1h后用甘氨酸封闭,透析后定量,得到多聚sa。采用空间排阻色谱法(sec)进行分子量的测定(sec色谱图如图2所示),制得的多聚sa分子量约>150kda,范围从150kda~1340kda。
[0085]
实施例2
[0086]
荧光微球平台-心肌肌钙蛋白i(ctni)检测层析试纸条
[0087]
1、检测抗体-荧光微球制备
[0088]
取200微升黄绿光荧光微球母液,于4℃15000rpm离心5min,离心完后去上清,加活化缓冲液复溶,超声分散均匀;分别加入终浓度为0.2mg/ml的edc及5mg/ml的nhs溶液,室温避光混匀18min后,于4℃15000rpm离心5min,去上清;加入偶联缓冲液复溶,超声分散均匀,于4℃15000rpm离心5min,去上清,复溶于偶联缓冲液中,超声分散均匀,加入60μg检测抗体ab1(即ctni ab1),包铝箔纸避光,放混匀器震荡反应2.5h;反应完成后离心去上清,加入200μl封闭缓冲液,超声分散均匀后置于混匀器上震荡反应45min;封闭完后于4℃15000rpm离心5min,去上清;加入200微升洗涤液复溶,超声分散均匀,在4℃15000rpm离心5min,去上清,最后加入荧光微球保存液200μl复溶,超声均匀,4℃保存。
[0089]
2、检测抗体ab1-荧光微球结合垫的制备
[0090]
将制备好的检测抗体ab1-荧光微球按照15%的浓度制备微球工作液,同时在微球工作液中添加1%浓度的羊抗鸡igy-荧光微球、1%伊文思蓝染液,按照4μl/cm的条件用喷金点膜仪均匀喷在玻璃纤维上,于50℃烘干2小时,制备得ab1-荧光微球结合垫。
[0091]
3、nc膜的制备
[0092]
将硝酸纤维素膜、吸水纸粘贴在pvc底板上,用包被稀释液将sa(也即是链霉亲和素)或实施例1制得的多聚sa分别稀释至1mg/ml,同时也将c线包被抗体鸡igy稀释至1mg/ml,用喷金点膜仪以1μl/cm的参数均匀划在nc膜上,于37℃烘干2小时。
[0093]
4、生物素化捕获抗体的制备
[0094]
将捕获抗体ab2(即ctni ab2)与生物素混合反应1h后于透析袋中透析4小时,制得生物素化的捕获抗体ab2。
[0095]
5、样品垫的制备
[0096]
将生物素化的捕获抗体ab2稀释至2μg/ml,并加入终浓度0.4mg/ml的阻断剂m009制备成工作液,均匀涂抹在玻璃纤维上,于37℃烘干2小时后备用。
[0097]
6、ctni检测试纸条的组装及检测
[0098]
将标记垫、样品垫、nc膜按照图示1位置组装,用切条机均匀切3mm/条。加样50μl后于试纸条上反应15min后置于荧光检测仪器中检测t、c信号值。
[0099]
对照组:对照组的试纸条的制备方法与上述试纸条的制备方法大致相同,其不同在于,对照组的试纸条的样品垫上没有包被生物素化的捕获抗体ab2,只包被了阻断剂,对照组的试纸条的t线上包被的是生物素化的捕获抗体ab2而非sa或多聚sa。
[0100]
检测结果如表1和图3所示。表1中,“t/c”表示t线与c线的荧光强度的比值,比值增长越快说明梯度越好。
[0101]
表1
[0102][0103]
在层析过程中,未聚合的链霉亲和素固定在t线之后容易出现扩散。由表1和图3可知,t线上包被多聚sa的试纸条在灵敏度和活性上有明显的提升,而t线上包被sa的试纸条的整体活性偏低,灵敏度差。
[0104]
7、临床验证
[0105]
以传统的试纸条(也即是步骤6中提及的对照组试纸条)作为对照,采用77个临床样本对t线包被多聚sa的试纸条进行验证,结果如表2所示。
[0106]
表2
[0107]
[0108]
[0109][0110]
由表2可知,t线上包被多聚sa的试纸条在临床相关性上更优,低值相关性上尤为明显。
[0111]
实施例3
[0112]
胶体金层析平台-新冠n抗原检测层析试纸条
[0113]
1、sars-cov-2的n蛋白的抗体1(即19covnab1或称新冠n抗体1)标记:取10ml 4/万(40nm)的胶体金,加入60μl 0.2m k2co3(ph≈6.8~7.2之间),搅拌5min,加入新冠n抗体1 100μg(所加抗体体积=100μg/抗体浓度),搅拌10min,再加入100μl 10%bsa封闭终止,标记搅拌10min;离心10000rpm,5min,去上清,沉淀用金子复溶液,复溶,最后用金子复溶液定容到1ml(即1/10胶体金溶液体积),制得胶体金标记的新冠n抗体1溶液。
[0114]
2、配制金子工作液:用金子稀释液将步骤1制得的胶体金标记的新冠n抗体1溶液最终稀释到10od配制成金子工作液,铺于玻璃纤维上。
[0115]
3、制备干燥好的金子:将铺好的金子放入冻干机冻干(2h)或者放37℃干燥房干燥过夜。
[0116]
4、包被膜:将实施例1制备的多聚sa或sa(即链霉亲和素)使用包被稀释液稀释至2.0mg/ml包被;放37℃恒温箱60min。
[0117]
5、处理样品垫:将生物素标记的sars-cov-2的n蛋白的抗体2(即19covnab2或称新冠n抗体2)用样品垫处理液(或新冠裂解液)稀释至5μg/ml,处理样品垫。样品垫1.6cm宽
×
10cm长铺800μl。
[0118]
6、制备金标条:用切条机将金标条按需要的宽度切条,组装后加样进行检测。结果如表3所示。需要说明的是,胶体金色卡的读数有c1、c2、c3、c4、c5、c6、c7、c8、c9、b一共10个梯度,且这10个梯度从左至右对应的t线颜色依次变浅,c1表示t线颜色为最深,c9表示t线颜色最浅,b表示不显色,b 为几乎不显色;表3中“c3 ”是指比c3颜色更深一点但未达到c2,其他带“ ”类推。
[0119]
对照组:对照组的试纸条的制备方法与上述试纸条的制备方法大致相同,其不同在于,对照组的试纸条的样品垫上没有包被生物素化的捕获抗体ab2,对照组的试纸条的t线上包被的是生物素化的捕获抗体ab2而非sa或多聚sa。
[0120]
表3
[0121][0122]
在层析过程中,未聚合的链霉亲和素固定在t线之后容易出现扩散。由表3可知,t线设置sa多聚体活性比sa高0.5~2c,比无sa-bio放大体系高0.5~1c。
[0123]
实施例4
[0124]
胶体金层析平台-hcv抗体检测层析试纸条
[0125]
采用hcv抗原1(hcv-ag1)标记胶体金,hcv抗原2(hcv-ag2)生物素化,参考实施例3方法进行制备;t线设置多聚sa或者sa。
[0126]
检测hcv抗体样品的结果显示,在hcv胶体金层析平台,sa多聚体检测样品活性整体比sa高0.5c以上。
[0127]
实施例5
[0128]
hcv抗原检测试剂盒,包括将多聚sa包被elisa板作为检测试剂,将hcv抗体1(hcv-ab1)标记生物素作为捕获剂;hcv抗体2(hcv-ab2)标记hrp作为标记剂。具体将多聚sa与包被液混合,包被于elisa板上,4℃包被后取出平衡置室温,洗板2次,拍干后4℃封闭过夜,干燥后待用,获得检测试剂;将hcv-ab1与生物素溶液混合,2-8℃交联,随后透析去除游离生物素,获得捕获剂;将hcv-ab2采用过碘酸钠法进行hrp标记,获得标记剂。用以上试剂盒测试待测样品,结果显示,与包被sa作为检测试剂相比,包被多聚sa作为检测试剂的整体检测活性提高。
[0129]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0130]
以上所述实施例仅表达了本发明的几种实施方式,便于具体和详细地理解本发明
的技术方案,但并不能因此而理解为对发明专利保护范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。应当理解的是,在本领域技术人员在本发明提供的技术方案的基础上,通过合乎逻辑的分析、推理或有限的试验得到的技术方案,均在本发明所附权利要求的保护范围内。因此,本发明专利的保护范围应以所附权利要求的内容为准,说明书及附图可以用于解释权利要求的内容。
当前第1页1
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!