氯毒素衍生物及其用途的制作方法-j9九游会真人
1.本发明涉及氯毒素衍生物。具体地,本发明涉及有用于靶向哺乳动物(尤其是人类)中的癌细胞的新的氯毒素衍生物。本发明还涉及使用该新的氯毒素衍生物靶向癌细胞的方法。
背景技术:
2.氯毒素特性
3.氯毒素(下文称为ctx)是一种小的36个氨基酸的蛋白,是一种胱氨酸结小蛋白[moore 2012],具有由四个二硫键稳定的紧凑三级结构。ctx首先从蝎子以色列金蝎(leiurus quinquestriatus)的毒液中分离出来,并因其阻断氯离子通道的能力而得名。ctx可以引起节肢动物的神经毒性[debin1993]。在术语氯毒素或ctx下,我们指的是野生型蛋白质,其序列显示在seq id no:1下。野生型ctx和一些ctx变体/衍生物的二硫化物模式如图1所示。野生型ctx的二硫化物模式是:c
2-c
19
、c
5-c
28
、c
16-c
33
和c
20-c
35
。
[0004]
在研究神经胶质瘤特异性氯化物电流时,发现ctx在体外和体内表现出与神经胶质瘤细胞的特异性和选择性结合,与正常脑组织的细胞相反[soroceanu 1998]。该发现提出了使用ctx作为靶向分子的构思,其将基于
131
i碘放射性同位素的细胞杀伤放射疗法聚焦于靶肿瘤细胞[mamelak2006]。免疫组织化学研究还表明,带有荧光或生物素标记的ctx样分子可以成功地用于神经胶质瘤的免疫组织化学标记[soroceanu 1998]。随后,在被分类为神经外胚层起源的肿瘤的各种不同肿瘤类型中更广泛地观察到ctx的肿瘤特异性结合[lyons 2002]。除了包含多形性胶质母细胞瘤(gbm)、间变型星形细胞瘤、星形细胞瘤和少突胶质细胞瘤在内的神经胶质瘤之外,lyons et al.描述了呈ctx阳性(即特异性结合剂)的许多其他原发性脑肿瘤,如神经胶质肉瘤、神经节胶质瘤、脑膜瘤、室管膜瘤,以及周围神经外胚层肿瘤,如髓母细胞瘤、神经母细胞瘤、神经节瘤、黑色素瘤(原发性和转移性)、嗜铬细胞瘤、尤文氏肉瘤、小细胞肺癌和神经鞘瘤。lyons et al.还证明了生物素化ctx与不同人类肿瘤来源的永生化细胞系的高度特异性结合,包括七种胶质母细胞瘤细胞系和六种外周神经外胚层肿瘤细胞系。还表明,在生理温度下的活细胞中,ctx通过不同的内化过程被吸收到肿瘤和非肿瘤细胞中,从而导致不同的细胞定位模式[wiranowska 2011]。在这项研究中,ctx被证明被受体介导的(也称为网格蛋白介导的)内吞作用摄取,以在胶质瘤细胞的内体区室中加工成溶酶体,从而导致在细胞中的保留时间延长。相反,在正常细胞(星形胶质细胞和成纤维细胞)中,ctx通过非受体介导的巨胞饮作用被摄取,随后快速释放,导致净摄取较少且不延长保留。这些特征可能在ctx的选择性肿瘤靶向特性中发挥重要作用。
[0005]
最初的毒液来源的ctx在c端具有甲酰胺(即天然蛋白,表示为ctx),而重组产生的ctx变体(下文表示为rctx)以c端精氨酸的羧基结尾。
[0006]
ctx的肿瘤选择性最初归因于与神经胶质瘤细胞中氯离子通道的结合。随后,基质金属蛋白酶2(mmp-2)被鉴定为ctx的受体,无论是单独的还是与mmp-14(基质金属蛋白酶14,也称为膜型-1基质金属蛋白酶(mt1-mmp))形成的蛋白复合物,金属蛋白酶2(timp-2)和
avβ3整合素的组织抑制剂[deshane 2003]。这种mmp-timp-整合素复合物被认为在细胞表面结合和释放的活性mmp-2的调节(成熟、锚定、激活和抑制)中发挥着关键作用,这些因素协同作用可能促进肿瘤侵袭、转移和血管生成[yosef2018]。
[0007]
然而,在后续研究中,ctx和重组产生的mmp-2之间的直接和特异性相互作用可能无法通过下拉测定法建立[veiseh 2007]。由于这种模糊性,另一个研究小组使用亲和柱、交联试剂和质谱重新研究了神经胶质瘤ctx受体的身份,并得出结论,包含ctx受体的直接结合伴侣蛋白可能是膜联蛋白2(anx2)[kesavan 2010];尽管他们承认了其他结合伴侣蛋白的可能性,并且没有证明ctx-anx2蛋白-蛋白与重组产生和纯化的anx2蛋白直接相互作用。
[0008]
又另一个研究小组确定神经毡蛋白-1(nrp1)(一种肿瘤和内皮细胞上的内吞受体)作为新的ctx靶点[mcgonigle 2019]。他们发现只有rctx能结合nrp1,而天然(即带有甲酰胺c末端的)ctx不结合nrp1,但在细胞环境中通过脱酰胺作用代谢为羧基变体。
[0009]
因此,鉴于存在争议的提议,ctx的真正靶蛋白仍然难以捉摸。特异性结合ctx的靶蛋白结构域或位点通常称为ctx受体[例如soroceanu1998;dardevet 2015],并且本文为了简单起见,我们也将使用这个术语。
[0010]
临床前和临床试验中含有ctx的构建体和ctx变体
[0011]
与特异性抗体靶向分子相比,小蛋白ctx可以穿过脑血屏障。这使得ctx成为创造新靶向分子的有希望的起点。
[0012]
根据一些专利申请,一些早期的临床前研究报告了合成生产的ctx(tm-601)对小鼠体内胶质母细胞瘤异种移植肿瘤生长的有效性,无论是单独使用还是与替莫唑胺组合使用[us20100215575 a1和us 20100210546]。然而,这些发现显然后来没有被科学出版物或后续临床研究证实,并且人们的兴趣转向了利用ctx作为靶向分子。
[0013]
尽管ctx的真正靶点尚不清楚,但该分子在癌症研究领域引起了人们的极大兴趣,用作诊断或治疗工具,或作为治疗诊断等用途的组合。[dardevet 2015]评论的多种用途是由于ctx的氨基酸序列提供了多种有用的化学修饰机会所带来的。此类修饰可以包括与多种化合物偶联,或连接其他肽序列作为用于偶联或环化的接头,这种修饰允许使用ctx作为靶向载体分子。靶向利用是通过所述明显特征实现的:此类修饰通常不会显著改变修饰的ctx化合物的靶识别(ctx受体结合)特性。例如,ctx在位置29含有单个酪氨酸残基,适用于碘化[soroceanu 1998];并且碘的某些放射性同位素(
123
i、
125
i和
131
i)通常用于各种临床前研究(例如结合研究中的
125
i)或临床成像(例如γ扫描或单光子发射计算机断层扫描-spect或spect/ct)或放射疗法应用,附着到靶向分子。临床1/2期研究以
131
i标记的ctx(在相关出版物中表示为tm-601)开始,都进行局部(腔内肿瘤部位)治疗施用和静脉成像(低剂量)施用。一项治疗性试验的1期结果已发表,显示出有希望的疗效和安全性信号[mamelak 2006];然而,批准的2期治疗性试验和诊断开发被停止,而没有公布任何结果。1期诊断(成像)研究显然提前终止了[clinicaltrials.gov上的参考号nct00683761]。
[0014]
wo 2011094671 a2描述了n末端偶联的多肽,其中多肽可以是ctx或其变体。此处描述了ctx可以帮助将缀合物靶向癌细胞群,并且ctx可以特异性结合mmp-2。
[0015]
得益于各种交联试剂的可用性,ctx分子的赖氨酸残基也适用于轻松地进行活性物质的缀合。ctx在位置15、23和27处具有三个赖氨酸残基,这些残基已用于与nhs-酯修饰
的花青5.5(cy5.5)和其他荧光分子缀合[akcan 2011;wo2011142858a2]。然而,为了在某些位置上高产率和可重复地产生均匀的缀合衍生物,代替各种单位点和多位点缀合产物的混合物,由于野生型ctx中三个赖氨酸残基的存在,ctx的一些修饰被认为是合理的。尽管混合物有可能获得美国食品和药物管理局(fda)以及其他地方类似监管机构的批准,但商业化可能会受到阻碍,因为其昂贵且难以匹配单、双和三标记批次的比例。因此,olson和同事提出了重新工程化ctx的例子。他们表明,用丙氨酸或精氨酸取代赖氨酸15和23消除了所得批次中的混合生物缀合物种类,同时与ctx相比保留了突变ctx蛋白的原位肿瘤染色活性[akcan 2011;wo2011142858a2]。因此,位置15和23处的赖氨酸-精氨酸取代(k15r,k23r)产生了ctx的单赖氨酸(k27)突变体(下文称为mctx;seq id no:2)。该mctx蛋白与表示为blz-100(inn名称托珠来肽(tozuleristide);cas登记号:1673565-40-6)的吲哚菁绿(icg)缀合。目前正处于2期临床开发[clinicaltrials.gov上的参考号nct03579602]用于人类肿瘤的术中可视化[dintzis 2019;patil 2019],即作为“肿瘤绘图("tumor paint")”。在研究ctx和mctx的荧光缀合物时,观察到这些缀合物被hela(宫颈癌)细胞内化,并且mctx的cy5.5-和alexa fluor 488-缀合物的细胞摄取比ctx的类似缀合物高出1.5倍和2倍[ojeda2017]。然而,这种差异是缀合的荧光团的特征,但不一定是未缀合的靶向ctx变体的特征。然而,对于术中可视化(“荧光引导手术”),可以使用其他几种荧光团缀合的ctx变体,最优选近红外染料,除了上述cy5.5和icg之外,还包括例如irdye 800cw、dylight 750或vivotag-s 750[stroud 2011]。
[0016]
wo 2015042202 a1公开了包含ctx变体的缀合物和试剂盒。根据一些实施方式,ctx变体与荧光部分形成缀合物。此处描述的缀合物适用于肿瘤的治疗和成像。
[0017]
2014年发表了一篇关于ctx特定发明的综述文章[cheng 2014]。此处描述了ctx可以特异性抑制胶质瘤细胞的生长和转移,并且可以加速肿瘤细胞凋亡。提供了一些关于ctx生物缀合物的参考。此处还描述了ctx特异性结合mmp-2受体。
[0018]
环化是一种延长多肽药物候选物在体外或体内血清半衰期的常用方法。akcan et al.已经表明ctx的环状变体保留了与恶性组织结合的能力[akcan 2011]。该环状变体是通过七肽(gagaagg)接头将c末端精氨酸与n末端蛋氨酸连接起来而产生的。这种修饰不仅延长了血浆中的半衰期,而且促进了单位点缀合。因此,对于本领域技术人员来说,用一些延伸的肽片段或用内置的额外二硫桥的任何环化可能是ctx变体亲本蛋白的明显修饰,使得此类修饰将保留亲本蛋白的靶向潜力。
[0019]
ctx作为靶向分子的另一种利用是应用ctx代替特异性蛋白质识别抗体进行嵌合抗原受体t细胞(car-t细胞)疗法。嵌合抗原受体(car)是经过基因工程化的受体蛋白,以赋予t细胞靶向存在于肿瘤细胞表面的特定蛋白质的新能力。这些受体是嵌合的,因为它们将抗原结合和t-细胞激活功能结合到单个受体中。因此,car由细胞外肿瘤识别/靶向结构域、细胞外接头/间隔子、跨膜结构域以及细胞内t细胞激活和共刺激信号传导结构域组成。专利申请号wo 2017/066481 a1描述了car-t构建体,其中细胞外肿瘤识别/靶向结构域是ctx、或相关毒素、或ctx变体。目前,使用ctx作为肿瘤靶向结构域的car-t细胞免疫疗法开发正处于临床1期[clinicaltrials.gov上的nct04214392],用于治疗mmp-2阳性胶质母细胞瘤患者。
[0020]
ctx作为靶向分子的另一种利用是将其偶联到抗增殖或细胞毒性有效载荷分子。
已将各种抗增殖药物附着至抗体或较小的靶向多肽上,以通过靶向分子实现特异性。最初,这些尝试旨在提高现有化疗药物的特异性,例如长春花生物碱和多柔比星。然而,抗体-药物缀合物(adc)近年来经历了巨大的发展,使得fda批准了一些抗体-药物缀合物,也有相当多的抗体-药物缀合物进入临床开发[lambert 2018]。当前临床开发中大多数adc中使用的细胞毒性化合物要么是多拉司他汀10(奥瑞他汀类)或美登素的衍生物,它们是有效的抗有丝分裂微管破坏剂,要么是多种高细胞毒性dna损伤剂之一的衍生物:卡奇霉素、多卡霉素、吡咯并苯并二氮杂卓二聚体和吲哚并苯并二氮杂卓假二聚体[lambert 2018]。这些载体-接头-有效载荷构建体基于这样的前提:细胞毒性化合物作用于细胞内靶标,并且靶向分子促进其特异性内化进入由细胞特异性靶蛋白的表面存在识别的细胞中。内化通过核内体-溶酶体途径发生,其中接头被切割和/或抗体被降解以释放有效载荷。因此,此类adc构建体已与溶酶体酶可切割或不可切割的接头组装在一起[lambert 2018]。专利申请号wo 2017/136769a1描述了ctx和念珠藻素衍生物的缀合物作为有效的抗癌治疗药物。除了奥瑞他汀类(例如单甲基奥瑞他汀e或f-mmae或mmaf)和美登素外,念珠藻素是另一种微管破坏剂。该专利申请的突出例子是通过可切割的二甲基二硫化物接头在赖氨酸27处与念珠藻素类似物偶联的ctx的载体-接头-有效载荷构建体。在胶质母细胞瘤、胰癌、前列腺癌和乳癌的皮下小鼠异种移植模型中,与不含ctx的类似接头-有效载荷构建体相比,该化合物具有卓越的抗肿瘤活性。
[0021]
进一步提出或开发的利用ctx作为靶向分子的诊断和治疗应用包括铂(iv)-ctx;聚合物点生物缀合物的缀合物;缀合的上转换纳米探针;ag-in-s/zns量子点;专为组合癌细胞靶向、成像和sirna递送而定制的具有钆磁性纳米载体的树状移植物聚赖氨酸;基于纳米载体的靶向基因递送;通过ctx-缀合的氧化铁纳米颗粒联合药物递送和mri对比增强;ctx-修饰的多柔比星负载的脂质体;[dardevet 2015;cohen 2018]综述的其他纳米颗粒和纳米探针。
[0022]
现有ctx构建体和变体的缺陷
[0023]
为了利用ctx作为诊断或治疗靶向剂,尽管进行了许多尝试,包括一些早期临床开发,但迄今为止,这些开发都没有导致授权引入(上市许可)进入医疗实践。目前,两种使用ctx作为靶向剂的方法(car-t和tozleristide)显然正在积极开发中。根据强制性临床研究数据库(例如clinicaltrials.gov)中公布的信息,一些其他进展似乎明显停止了。然而,失败或停止的原因并没有透露,只留下了猜测的空间。除了潜在的财务或管理问题之外,失败的一个明显原因可能是相对于与其他分子或细胞靶的不希望结合或对其他分子或细胞靶的不希望影响,其用作可用受体的亲和力或效力不足和/或对ctx的选择性不足。
[0024]
观察到ctx对u251mg、d54mg和u87mg胶质瘤细胞系的侵袭和迁移产生50%抑制效果(ic
50
)的浓度为约600nm[soroceanu 1999],这与在我们的mmp-2结合和置换实验中测量的范围为约500-700nm的ec
50
和ic
50
值一致(见下文)。这种具有高亚微摩尔有效浓度水平的中等效力意味着很难在体内达到足够有效的治疗或标记全身浓度。然而,靶向分子的选择性以向肿瘤细胞比向健康正常细胞带来更多的有效载荷分子,对于靶向分子的有效诊断和/或治疗应用甚至更为重要。因此,对于本领域技术人员来说,明显的假设是,在用于诊断和治疗恶性肿瘤的ctx相关研究领域中巨大的未满足的需求,在靶蛋白相关或细胞结合和功能效应方面,可以用更有效和/或更具选择性的化合物来更好地满足。此外,同一类型肿
瘤的不同肿瘤细胞系表现出多种标记蛋白表达。因此,需要具有不同识别特征的多种新的肿瘤细胞标志物识别分子,并且还需要将细胞特异性诊断工具与通过共同模式识别靶向分子(即“治疗诊断”)连接的匹配治疗工具偶联。然而,特异性抗体广泛用于此类目的,较小尺寸的特异性靶向分子可能比抗体具有优势,例如更好的渗透特性和生产成本效益。
技术实现要素:
[0025]
本发明背后的构思是,本发明的ctx衍生物(下文中称为ctxd或氯毒素衍生物)与基质金属蛋白酶2(mmp-2)蛋白的结合比ctx更强。因此,这些化合物被过表达mmp-2的许多神经外胚层肿瘤细胞更强烈地摄取,包括但不限于乳癌、胶质母细胞瘤、黑色素瘤和胰癌。令人惊讶的是,与非肿瘤细胞(如成纤维细胞、星形胶质细胞和内皮细胞)相比,与荧光团缀合的本发明的代表性化合物(即ctxd5和ctxd8,参见表ii)不仅表现出更强的细胞摄取,而且对所测试的神经外胚层肿瘤细胞具有更高的选择性。此外,研究与一组假设的纯化形式的靶蛋白的结合时,令人惊讶地发现ctx与除mmp-2之外的另一种蛋白(即nrp-1)的结合强度大致相似,并且它还与mmp-9、timp-2和氯离子通道clc3适度结合,而ctxd5和ctxd8也显示出增加的靶蛋白选择性,仅表现出与mmp-2的明显结合以及与timp-2和clc3的非常弱的结合。此外,ctxd5和ctxd8与其主要靶蛋白mmp-2的亲和力并未因为在其赖氨酸残基处与相对大分子(例如具有设计的接头结构的化疗细胞生长抑制化合物或荧光标签荧光团化合物)缀合而显著改变。这些观察共同得出这样的结论:本发明的化合物作为靶向分子是有用的,并且比ctx或mctx更好,无论是单独的还是与其他分子、纳米颗粒、car-t细胞构建体缀合,所述其他分子、纳米颗粒、car-t细胞构建体提供了能够进行诊断、或治疗、或诊断和治疗组合(也称为“治疗诊断”应用)的附加特征,这从与ctx的此类假定利用相关的现有技术中可能是显而易见的。本发明的蛋白质可以是本领域技术人员进一步修饰或延伸ctx衍生物的起点,例如环化以延长蛋白质药物候选物在血清中的半衰期。
[0026]
鉴于上述,本发明涉及包含以下通用序列的氨基酸序列的氯毒素衍生物
[0027]
x0x1cmpcx
s1
x
s2
x
s3
dhx
s4
x
s5
arrcx2x3ccggygx4cfgyqclcx5x6x7x8(seq id no:43)
[0028]
其中
[0029]
(i)n末端x0x1簇选自am、0m或00;
[0030]
(ii)溶解性x
s1
x
s2
x
s3
x
s4
x
s5
簇选自fttqt、fttes、sssqt、ssses、fssqt、fsses或fssqs;
[0031]
(iii)内部x2x3x4簇选自dkr、rdk、kdr、iky、hkw、drk、lkq、kkk;并且
[0032]
(iv)c末端x5x6x7x8簇选自n000、r000、nr00、nrg0、nrgy、nrrr或rrrr;
[0033]
其中0表示不存在氨基酸的位置。
[0034]
根据一个优选的实施方式,本发明涉及包含以下通用序列的氨基酸序列的氯毒素衍生物
[0035]
x0x1cmpcfttdhqtarrcx2x3ccggygx4cfgyqclcx5x6x7x8(seq id no:35)
[0036]
其中
[0037]
(i)n末端x0x1簇选自am、0m或00;
[0038]
(ii)内部x2x3x4簇选自dkr、rdk、kdr、iky、hkw、drk、lkq、kkk;并且
[0039]
(iii)c末端x5x6x7x8簇选自n000、r000、nr00、nrg0或nrgy;
[0040]
其中0表示不存在氨基酸的位置。
[0041]
根据一个优选的实施方式,氯毒素衍生物的内部x2x3x4簇是dkr。
[0042]
根据一个更优选的实施方式,氯毒素衍生物选自具有seq id no:3至seq id no:18和seq id no:36至seq id no:42所示序列中的任何一个的氯毒素衍生物。根据甚至更优选的实施方式,氯毒素衍生物具有seq id no:4或seq id no:42中所示的序列。
[0043]
根据另一个优选的实施方式,氯毒素衍生物是环状的。
[0044]
本发明进一步涉及缀合物,其中该缀合物包含本发明的氯毒素衍生物和辅基。
[0045]
辅基优选选自以下药剂:
[0046]
(i)可视化药剂,优选选自荧光标签、放射性标签、磁共振成像标签、以及能够通过与标签分子高亲和力结合来进行间接标记的药剂;
[0047]
(ii)治疗剂,优选选自化疗剂和生物治疗剂;
[0048]
(iii)靶向剂,优选选自抗体、多肽、多糖和核酸;
[0049]
(iv)增加循环半衰期的部分,优选选自peg部分、糖基部分、糖基peg部分和能够经由接头延伸环化权利要求1至5中任一项的氯毒素衍生物的部分。
[0050]
根据本发明的另一优选实施方式,缀合物在氯毒素衍生物和辅基(prosthetic group)之间包含一个或多个接头和可选的一个或多个间隔子。接头优选选自肽、二甲基二硫化物接头、戊二酰接头、组织蛋白酶可切割的接头。
[0051]
本发明进一步涉及一种包含第一缀合物和第二缀合物的缀合物治疗诊断对(theranostic pair),其中两种缀合物都是本发明的缀合物。根据本发明的一个优选实施方式,所述两种缀合物的氯毒素衍生物部分具有相同的氨基酸序列,并且所述两种缀合物具有不同的辅基。根据另一个优选实施方式,所述第一缀合物和所述第二缀合物的氯毒素衍生物部分具有不同的氨基酸序列,并且所述第一缀合物和所述第二缀合物具有相同或不同的辅基。
[0052]
本发明进一步涉及一种包含本发明的缀合物和使用说明的试剂盒。根据另一个实施方式,该试剂盒包含本发明的治疗诊断对和使用说明。
[0053]
本发明进一步涉及包含本发明的缀合物的药物组合物,其中所述缀合物的辅基是治疗剂或可视化药剂并且该药物组合物还包含药学上可接受的赋形剂。
[0054]
本发明进一步涉及一种本发明的缀合物,该缀合物用于治疗癌症,或用于诊断癌症。根据一个优选的实施方式,癌症选自乳癌、宫颈癌、结肠癌、室管膜瘤、尤文氏肉瘤、神经节神经胶质瘤、神经节瘤、神经胶质瘤、胶质母细胞瘤、胶质肉瘤、成神经管细胞瘤、脑膜瘤、成神经细胞瘤、黑色素瘤(原发性和转移性)、胰癌、嗜铬细胞瘤、前列腺癌、神经鞘瘤和小细胞肺癌。根据最优选的实施方式,癌症选自乳癌、胶质母细胞瘤、黑色素瘤和胰癌。
[0055]
本发明进一步涉及一种本发明的缀合物,该缀合物用于癌组织的可视化。根据一个优选的实施方式,癌组织选自乳癌、宫颈癌、结肠癌、室管膜瘤、尤文氏肉瘤、神经节神经胶质瘤、神经节瘤、神经胶质瘤、胶质母细胞瘤、胶质肉瘤、成神经管细胞瘤、脑膜瘤、成神经细胞瘤、黑色素瘤(原发性和转移性)、胰癌、嗜铬细胞瘤、前列腺癌、神经鞘瘤和小细胞肺癌。根据最优选的实施方式,癌组织选自乳癌、胶质母细胞瘤、黑色素瘤和胰癌。
[0056]
本发明进一步涉及一种通过施用有效剂量的根据本发明的缀合物来治疗患有癌症的患者的方法,其中辅基是适合于治疗癌症的治疗剂。根据一个优选的实施方式,癌症选
自乳癌、宫颈癌、结肠癌、室管膜瘤、尤文氏肉瘤、神经节神经胶质瘤、神经节瘤、神经胶质瘤、胶质母细胞瘤、胶质肉瘤、成神经管细胞瘤、脑膜瘤、成神经细胞瘤、黑色素瘤(原发性和转移性)、胰癌、嗜铬细胞瘤、前列腺癌、神经鞘瘤和小细胞肺癌。根据最优选的实施方式,癌症选自乳癌、胶质母细胞瘤、黑色素瘤和胰癌。
[0057]
本发明进一步涉及一种通过施用根据本发明的药物组合物来治疗患有癌症的患者的方法,其中缀合物的辅基是适合于治疗癌症的治疗剂。根据一个优选的实施方式,癌症选自乳癌、宫颈癌、结肠癌、室管膜瘤、尤文氏肉瘤、神经节神经胶质瘤、神经节瘤、神经胶质瘤、胶质母细胞瘤、胶质肉瘤、成神经管细胞瘤、脑膜瘤、成神经细胞瘤、黑色素瘤(原发性和转移性)、胰癌、嗜铬细胞瘤、前列腺癌、神经鞘瘤、小细胞肺癌。根据最优选的实施方式,癌症选自乳癌、胶质母细胞瘤、黑色素瘤和胰癌。
[0058]
本发明进一步涉及一种制备缀合物的方法,该方法包括以下步骤:
[0059]
a)提供本发明的氯毒素衍生物;
[0060]
b)可选地将接头基团结合至步骤a)的氯毒素衍生物;
[0061]
c)将辅基结合至步骤b)中形成的化合物的接头部分,或在不存在接头的情况下直接结合至步骤a)的蛋白质。
[0062]
本发明进一步涉及一种用于使癌组织可视化的方法,包含使待检查的组织与本发明的缀合物接触的步骤,其中所述缀合物的辅基是适合于使癌组织可视化的可视化药剂。
[0063]
本发明进一步涉及一种编码嵌合抗原受体的核酸分子,其中所述嵌合抗原受体包含:
[0064]
a)根据本发明的氯毒素衍生物;
[0065]
b)可选地在氯毒素衍生物和跨膜结构域之间的间隔子;
[0066]
c)跨膜结构域;
[0067]
d)一个或两个共刺激结构域;
[0068]
e)信号结构域;
[0069]
其中所述氯毒素衍生物使得嵌合抗原受体在t细胞表面表达时能够将t细胞活性引导至癌细胞。
[0070]
根据一个优选的实施方式,本发明的核酸分子编码嵌合抗原受体,其中氯毒素衍生物选自具有seq id no:3至seq id no:18和seq id no:36至seq id no:42(优选seq id no:4或seq id no:42)所示序列中的任一个的氯毒素衍生物。
[0071]
根据另一个优选的实施方式,所述本发明的核酸分子编码嵌合抗原受体,其中
[0072]
i)所述跨膜结构域选自cd4跨膜结构域或其变体、cd8跨膜结构域或其变体、cd28跨膜结构域或其变体以及cd3ζ跨膜结构域或其变体;
[0073]
ii)所述一个或两个共刺激结构域选自cd28共刺激结构域或其变体、4-1bb共刺激结构域或其变体和ox40共刺激结构域或其变体;
[0074]
iii)所述信号结构域是cd3ζ信号结构域或其变体。
[0075]
本发明进一步涉及一种包含本发明的核酸分子的载体。
[0076]
本发明进一步涉及一种人类细胞的群体,其:
[0077]
i)被包含表达盒的rna或dna载体转染,所述表达盒包含本发明的核酸,其中转染在体内或离体进行;或
[0078]
ii)被包含表达盒的病毒载体转导,所述表达盒包含本发明的核酸,其中转导在体内或离体进行,其中病毒载体优选是逆转录病毒或慢病毒载体;并且其中所述人类细胞选自:自体人类t细胞、自体人类cd4 辅助t细胞、自体人类cd8 细胞毒性t细胞、自体人类cd4 辅助t细胞和cd8 细胞毒性t细胞以任何比例的混合物、同种异体的人类t细胞、同种异体人类cd4 辅助t细胞、同种异体人类cd8 细胞毒性t细胞、同种异体人类cd4 辅助t细胞和cd8 细胞毒性t细胞以任何比例的混合物、自体原代人类自然杀伤(nk)细胞、同种异体原代人类自然杀伤(nk)细胞、nk-92细胞系的同种异体细胞、自体人类单核细胞、自体人类巨噬细胞、同种异体人类单核细胞、同种异体人类巨噬细胞。
[0079]
本发明进一步涉及一种治疗患者中癌症的方法,包含施用一个或多个根据本发明的人类细胞的群体。
附图说明
[0080]
图1描绘了一些也显示出二硫化物模式的ctx变体/衍生物的序列,其中
[0081]
ctx和rctx的序列如seq id no:1所示;
[0082]
mctx的序列如seq id no:2所示;
[0083]
ctxd5的序列如seq id no:4所示;
[0084]
ctxd8的序列如seq id no:42所示。
[0085]
图2描绘了与单甲基澳瑞他汀f(mmaf)形成的ctxd5的可切割细胞抑制缀合物。
[0086]
图3描绘了co-珠测试中噬菌体展示的ctx和ctxd的mmp-2和nrp1结合强度。
[0087]
图4描绘了磁珠测试中通过ctx-cy5的置换的ctxd5、ctxd8和ctx的mmp-2结合亲和力。
[0088]
图5描绘了磁珠测试中ctxd5-cy5、ctxd8-cy5和ctx-cy5的mmp-2结合。
[0089]
图6描绘了co-珠测试中ctx-cy5、ctxd5-cy5和ctxd8-cy5与假定的靶蛋白的结合。
[0090]
图7描绘了磁珠测试中ctxd5-cy5和ctx-cy5的nrp1结合。
[0091]
图8描绘了u251和panc-1细胞中ctxd5-cy5和ctx-cy5的浓度-摄取关系。
[0092]
图9描绘了以1:1效应物与靶细胞比率暴露于ctxd8-car和ctx-car以及未转导(nt)对照t淋巴细胞的mda-her2乳癌衍生细胞的活力。
[0093]
图10描绘了暴露于不同效应细胞数的ctxd8-car和ctx-car以及对照t淋巴细胞的mda-her2乳癌衍生细胞的活力。
[0094]
图11描绘了ctxd8-car构建体的氨基酸序列。
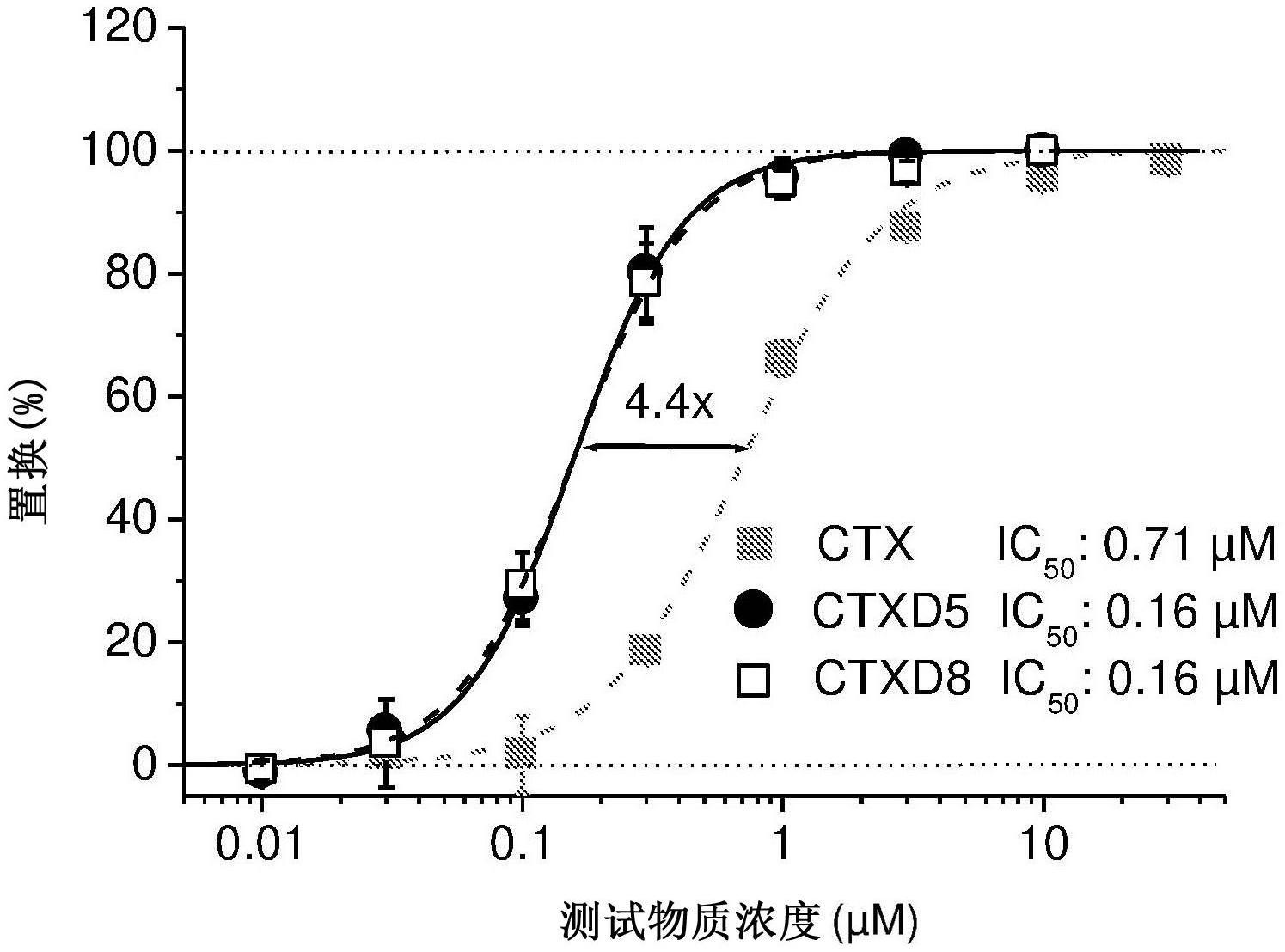
具体实施方式
[0095]
在本说明书的上下文中,术语“变体”、“氯毒素变体”或“ctx变体”下的那些蛋白质应理解为不同于野生型ctx并且是现有技术的一部分的蛋白质。
[0096]
在本说明书的上下文中,术语“衍生物”、“氯毒素衍生物”、“ctx衍生物”或“ctxd”下的那些蛋白质应理解为在导致本发明的项目期间开发的蛋白质。
[0097]
带有末尾序列号的术语ctxd是指氯毒素衍生物(蛋白质)或产生所述氯毒素衍生物的噬菌体克隆。本说明书中提到的每种特定ctxd都具有特定的氨基酸序列。例如,本说明书中的ctxd5是指具有根据seq id no:4的序列的蛋白质,本说明书中的ctxd1是指具有根
据seq id no:17的序列的蛋白质。
[0098]
术语“癌症”用于指其中异常细胞不受控制地分裂并可能侵入附近组织的疾病(此定义基于本专利申请提交日https://www.cancer.gov/publications/dictionaries/cancer-terms/def/cancer的描述)。癌细胞还可以通过血液和淋巴系统扩散到身体的其他部位。癌症有多种主要类型。癌是一种始于皮肤中或内脏器官内衬或覆盖的组织中的癌症。肉瘤是一种始于骨、软骨、脂肪、肌肉、血管或其他结缔或支持组织的癌症。白血病是一种始于造血组织(例如骨髓)并导致产生过多的异常血细胞的癌症。淋巴瘤和多发性骨髓瘤是始于免疫系统细胞的癌症。中枢神经系统癌症是始于脑和脊髓组织的癌症。癌症也称为恶性肿瘤。
[0099]
术语“癌性”被理解为哺乳动物或人类患者的状态,该状态涉及癌症。
[0100]
术语“治疗诊断”源自治疗和诊断这两个词的组合。该术语指的是诊断技术和治疗技术的独特组合,从而将特定的诊断技术与治疗方法或产品相结合,为识别适当的治疗敏感患者、组织或细胞群提供指导[jeelani 2014]。
[0101]
本发明的氯毒素衍生物包含以下一般氨基酸序列:
[0102]
x0x1cmpcx
s1
x
s2
x
s3
dhx
s4
x
s5
arrcx2x3ccggygx4cfgyqclcx5x6x7x8(seq id no:43)
[0103]
其中
[0104]
(i)n末端x0x1簇选自am、0m或00;
[0105]
(ii)溶解性x
s1
x
s2
x
s3
x
s4
x
s5
簇选自fttqt、fttes、sssqt、ssses、fssqt、fsses或fssqs;
[0106]
(iii)内部x2x3x4簇选自dkr、rdk、kdr、iky、hkw、drk、lkq、kkk;和
[0107]
(iv)c末端x5x6x7x8簇选自n000、r000、nr00、nrg0、nrgy、nrrr或rrrr;
[0108]
其中0表示不存在氨基酸的位置。
[0109]
根据一个优选的实施方式,本发明涉及包含以下通用序列的氨基酸序列的氯毒素衍生物
[0110]
x0x1cmpcfttdhqtarrcx2x3ccggygx4cfgyqclcx5x6x7x8(seq id no:35)
[0111]
其中
[0112]
(i)n末端x0x1簇选自am、0m或00;
[0113]
(ii)内部x2x3x4簇选自dkr、rdk、kdr、iky、hkw、drk、lkq、kkk;和
[0114]
(iii)c末端x5x6x7x8簇选自n000、r000、nr00、nrg0或nrgy;
[0115]
其中0表示不存在氨基酸的位置。
[0116]
需要注意的是,并非序列表中所示的seq id no:35和seq id no:43的所有可能变体都落入本发明的范围内,而是仅那些满足上述簇定义的变体落入本发明的范围内。
[0117]
通用序列seq id no:35和seq id no:43分别具有三个和四个可变簇。n末端有一个n末端簇(x0x1簇)、溶解性簇(x
s1
x
s2
x
s3
x
s4
x
s5
簇,仅在seq id no:43中)、内部簇(x2x3x4簇)和在c末端的c末端簇(x5x6x7x8簇)。所有这些簇都具有一定的、有限的氨基酸组成。然而,人们发现簇的组成是相互独立的。
[0118]
n末端簇由两个位置组成,即位置x0和x1。n末端簇的组成可以是am、0m或00。此处,a表示丙氨酸(ala),并且m表示甲硫氨酸(met)。0表示不存在氨基酸的位置。因此,n末端簇可以具有ala-met二聚体,或仅具有met单体,或者该n末端簇可以保持为空,即在这些位置中
没有氨基酸。
[0119]
溶解性簇是靠近n末端的x
s1
x
s2
x
s3
x
s4
x
s5
簇(仅在seq id no:43中)。它由x
s1
、x
s2
、x
s3
、x
s4
和x
s5
五个位置组成,其中指数中的“s”指的是“溶解性”的特性。显然,形成可溶性簇的氨基酸不一定是序列中相邻的氨基酸,存在两个子簇,即x
s1
x
s2
x
s3
和x
s4
x
s5
。溶解性簇可以具有以下组成:fttqt、fttes、sssqt、ssses、fssqt、fsses或fssqs。例如,如果x
s1
x
s2
x
s3
x
s4
x
s5
溶解性簇的组成是fttqt,则应当理解,x
s1
位置上的氨基酸是f,表示苯丙氨酸(phe),x
s2
、x
s3
和x
s5
位置上的氨基酸是表示苏氨酸(thr)的t,并且x
s4
位置的氨基酸是表示谷氨酰胺(gln)的q。在该溶解性簇中可以发现的进一步氨基酸是表示谷氨酸(glu)的e和表示丝氨酸(ser)的s。
[0120]
内部簇是大约位于氨基酸序列中间的x2x3x4簇,由x2、x3和x4三个位置组成。显然,形成内部簇的氨基酸不一定是序列中相邻的氨基酸。尽管位置x2和x3的氨基酸是相邻的,但位置x4的氨基酸在c末端方向上远离7个位置。内部x2x3x4簇可以具有以下组成:dkr、rdk、kdr、iky、hkw、drk、lkq、kkk。例如,如果内部x2x3x4簇的组成被称为dkr(这是本发明的优选实施方式之一),则应当理解,x2位置上的氨基酸是表示天冬氨酸(asp)的d,x3位置的氨基酸是表示赖氨酸(lys)的k,并且x4位置的氨基酸是表示精氨酸(arg)的r。在此内部簇中可以找到的其他氨基酸是表示异亮氨酸(ile)的i、表示酪氨酸(tyr)的y、表示组氨酸(his)的h、表示色氨酸(trp)的w、表示亮氨酸(leu)的l、和表示谷氨酰胺(gln)的q。
[0121]
c末端簇由四个位置组成,即位置x5、x6、x7和x8。c末端簇的组成可以是n000、r000、nr00、nrg0或nrgy。此处,n表示天冬酰胺(asn),r表示精氨酸(arg),g表示甘氨酸(gly),并且y表示酪氨酸(tyr)。0表示不存在氨基酸的位置。显然,该c末端簇可以仅具有一个氨基酸n或r(即如果x5x6x7x8的含义是n000或r000),在这些情况下,本发明氯毒素衍生物在c末端以位置x5结束。此外,c末端簇可以具有两个氨基酸(即如果x5x6x7x8的含义是nr00),或三个氨基酸(即如果x5x6x7x8的含义是nrg0),或四个氨基酸(即如果x5x6x7x8的含义在seq id no:35的情况下为nrgy,并且在seq id no:43的情况下为nrgy、nrrr或rrrr)。
[0122]
根据本发明的一个优选实施方式,氯毒素衍生物选自具有seq id no:3至seq id no:18和seq id no:36至seq id no:42所示序列中的任一个的氯毒素衍生物。seq id no:43定义的化学空间涵盖seq id no:3至seq id no:18和seq id no:36至seq id no:42所示的所有氯毒素衍生物。除序列表外,与这些序列相对应的氯毒素衍生物示于表i和表ii中。
[0123]
根据本发明的一个更优选的实施方式,氯毒素衍生物选自具有seq id no:3至seq id no:18所示序列任一个的氯毒素衍生物。seq id no:35定义的化学空间涵盖seq id no:3至seq id no:18所示的所有氯毒素衍生物。除了序列表之外,对应于这些序列的氯毒素衍生物示于表i中。
[0124]
根据本发明的一个甚至更优选的实施方式,氯毒素衍生物具有seq id no:4或seq id no:42所示的氨基酸序列。具有seq id no:4的氨基酸序列的蛋白质在本说明书中也称为ctxd5。具有seq id no:42的氨基酸序列的蛋白质在本说明书中也称为ctxd8。
[0125]
本发明的氯毒素衍生物可以是环状蛋白。本领域技术人员众所周知,环化的蛋白质可以比线性形式的蛋白质更稳定。如上所述,ctx的环状变体保留了与恶性组织结合的能力[akcan 2011]。因此,本领域技术人员明显预期,任何氯毒素衍生物都可以被环化,并且从而增加其半衰期。蛋白质环化方法是本领域技术人员众所周知的[di 2015]。在本发明的
范围内,术语“环状”是指氯毒素衍生物本身或通过插入接头而形成环状的,条件是给定的环化不会以负面方式显著影响氯毒素衍生物的所需效果,例如氯毒素衍生物与mmp-2蛋白的亲和力。
[0126]
本发明的氯毒素衍生物能够有效地识别并结合癌细胞。因此,它们适合于将化学实体递送至所述癌细胞,该化学实体一旦与癌细胞结合即可发挥所需的功能。在本发明的范围内,术语“缀合物”下的构建体应理解为包含至少氯毒素衍生物和辅基的构建体。根据本发明,所述化学实体是辅基的形式。在本发明的范围内,术语“辅基”下的任何化学实体应理解为通过主价键(即共价键或离子键)与根据本发明的氯毒素衍生物结合的化学实体。辅基的范围可以从单个原子延伸到大蛋白质。
[0127]
辅基优选是可视化药剂。即,在本发明的一个优选实施方式中,根据本发明的氯毒素衍生物与辅基形成缀合物,其中辅基是可视化药剂。因此,此类缀合物适用于使结合所述氯毒素衍生物的身体部分(例如人体)可视化。可视化药剂及其与某些蛋白质化学结合的方法是本领域技术人员已知的。在本发明意义上优选的可视化药剂是
[0128]
i)荧光标签,如花青染料(例如吲哚菁绿);
[0129]
ii)放射性标签,如
123
i、
125
i和
131
i的碘同位素;
[0130]
iii)磁共振成像标签,如硼纳米颗粒、硼和碳纳米颗粒、碳化硼纳米颗粒、含硼聚合物、含硼和碳的聚合物、碳化硼聚合物、还包含钆的这些纳米颗粒或聚合物中的任何一种;
[0131]
iv)通过与标签分子(如生物素、亲和素、组氨酸标签)高亲和力结合实现间接标记的药剂。
[0132]
如果可视化药剂是荧光标签,则其可以优选地用于荧光引导手术。在该手术过程中,本发明的缀合物使通过氯毒素衍生物部分结合缀合物的那些细胞或组织部分可见。因此,进行手术的医生可以看到这些细胞或组织部分。优选地,近红外染料(包括但不限于吲哚菁绿、花青5.5、irdye 800cw、dylight 750或vivotag-s 750)适用于此目的。
[0133]
使用其中辅基是荧光标签的本发明缀合物的另一个优选实例是当在流式细胞术方法中或在组织学染色过程中分析靶细胞时。在这种情况下,本发明的缀合物用作诊断剂。
[0134]
根据另一个优选的实施方式,辅基是治疗剂。即,在本发明的一个优选实施方式中,根据本发明的氯毒素衍生物与辅基形成缀合物,其中辅基是治疗剂。因此,此类缀合物适用于疗法,其中缀合物的氯毒素部分识别癌组织并与其结合。缀合物的治疗部分由此变得与所述癌组织紧密接近或内化到其细胞中并发挥其治疗效果。治疗剂及其与某些蛋白质化学结合的方法是本领域技术人员已知的。在本发明的意义上,优选的治疗剂是:
[0135]
i)化疗剂,如奥瑞他汀类、念珠藻素、卡奇霉素、多卡霉素、吡咯并苯并二氮杂卓二聚体、吲哚并苯并二氮杂卓假二聚体、美登素、甲氨蝶呤、多西他赛、顺铂和依托泊苷;
[0136]
ii)生物治疗剂,如cdna、sirna、shrna和rnai。
[0137]
用单甲基澳瑞他汀f(mmaf)形成的缀合物是适合于治疗目的本发明缀合物的实例(详情参见例如“化学工具箱(chemical toolbox)”,下文项目3.3或实施例4)。
[0138]
根据进一步优选的实施方式,辅基是靶向剂。即,在本发明的一个优选实施方式中,根据本发明的氯毒素衍生物与辅基形成缀合物,其中辅基是另一种靶向剂。因此,这种在靶细胞上具有双结合位点的缀合物提供了对靶向的细胞或组织具有甚至更高亲和力的
靶向分子。靶向剂及其与某些蛋白质化学结合的方法是本领域技术人员已知的。在本发明的意义上,优选的靶向剂是抗体、多肽、多糖和核酸。
[0139]
根据另一个优选的实施方式,辅基是增加循环半衰期的部分。即,在本发明的一个优选实施方式中,根据本发明的氯毒素衍生物与辅基形成缀合物,其中辅基是增加循环半衰期的部分。因此,此类缀合物可以减轻ctxd的代谢。增加循环半衰期的部分以及它们与某些蛋白质化学结合的方法是本领域技术人员已知的。在本发明的意义上,增加循环半衰期的优选部分是peg部分、糖基部分、糖基peg部分和能够通过接头延伸使本发明氯毒素衍生物环化的部分。
[0140]
氯毒素衍生物和辅基一起形成本发明的缀合物。在某些情况下,需要在氯毒素衍生物和辅基之间建立接头部分。例如,当辅基不能直接与氯毒素衍生物化学结合时,必须使用接头。如果辅基到达其靶位置(例如癌细胞)后需要释放,则可以使用特别可切割的接头。接头是本领域技术人员已知的,接头的实例是肽、二甲基二硫化物接头、戊二酰基接头、组织蛋白酶可切割的接头。对于本领域技术人员显而易见的是,在某些氯毒素衍生物-辅基构建体中可以使用多于一个接头。
[0141]
尽管存在一个或多个接头,但某些类型的辅基需要从氯毒素衍生物中延伸出来以发挥其作用。为此目的,可以在氯毒素衍生物和辅基之间应用一个或多个间隔子。间隔子部分通过主价键(即共价键或离子键)与辅基、或接头或氯毒素衍生物结合。
[0142]
对于本领域技术人员来说显而易见的是,有时辅基、接头和间隔子不能严格区分,它们的边界在某些情况下是不精确的。例如,一些辅基可能具有可以充当接头的尾部区域。
[0143]
治疗诊断对可以选自本发明的缀合物。这两种缀合物,即第一缀合物和第二缀合物,可以相同或可以不同。根据本发明的一个优选实施方式,所述两种缀合物的氯毒素衍生物部分具有相同的氨基酸序列,并且所述两种缀合物具有不同的辅基。
[0144]
术语“治疗诊断”是指组合的诊断和治疗应用,如本领域技术人员已知的。简而言之,治疗诊断对的成员之一适合于诊断目的,治疗诊断对的另一个成员适合于治疗目的。
[0145]
治疗诊断对的成员可以在空间和/或时间上单独使用,也可以同时使用。本发明的治疗诊断对通常具有相同的氯毒素衍生物(即相同的氨基酸序列),从而两种缀合物结合至相同的癌组织。然而,本发明的典型治疗诊断对具有不同的辅基,一个用于诊断目的(例如可视化药剂),并且另一个用于治疗目的(例如化疗剂)。对于本领域技术人员显而易见的是,本发明的相同缀合物还可以形成治疗诊断对,其中所述缀合物的辅基具有诊断和治疗特征。另一方面,本发明的治疗诊断对的成员在氯毒素衍生物部分和不同的辅基中也可以具有不同的氨基酸序列。
[0146]
本发明还涉及试剂盒,其包含本发明的缀合物和使用说明。本发明的缀合物可以以溶液或冻干物的形式提供在试剂盒中。使用说明以本领域技术人员可以理解的水平描述了试剂盒的缀合物的使用。使用说明可以是纸质、电子数据载体的形式,也可以在线获取。该试剂盒可以还包含溶液、缓冲液、试剂、实验室装置的一次性部件。
[0147]
本发明还涉及试剂盒,其包含本发明的治疗诊断对和使用说明。本发明的治疗诊断对可以以溶液或冻干物的形式提供在试剂盒中。使用说明书以本领域技术人员可以理解的水平描述了试剂盒的治疗诊断对的使用。使用说明可以是纸质、电子数据载体的形式,也可以在线获取。该试剂盒可以还包含溶液、缓冲液、试剂、实验室装置的一次性部件。
[0148]
本发明进一步涉及一种包含本发明的缀合物和药学上可接受的赋形剂的药物组合物,其中所述缀合物的辅基是治疗剂或可视化药剂。如果本发明的药物组合物用于治疗,则辅基应当是治疗剂。如果本发明的药物组合物用于可视化,则辅基应当是可视化药剂。
[0149]
本发明的药物组合物可以通过肠胃外、皮下、静脉内、肌内、腹膜内、经皮或口腔途径施用。由于该药物组合物适合于治疗肿瘤,优选的施用方式是微量输注局部施用于待治疗的肿瘤。待施用的药物组合物的剂量将取决于肿瘤的类型、患者的年龄、健康状况和体重、可选的并行治疗的类型、治疗的频率以及要实现的效果性质。本领域技术人员可以根据上述数据确定剂量。典型剂量包含1.0pg/kg体重至100mg/kg体重。全身施用的优选剂量包含100.0ng/kg体重至10.0mg/kg体重。通过微量输注向部位直接施用的优选剂量包含1ng/kg体重至1mg/kg体重。
[0150]
本发明药物组合物中的药学上可接受的赋形剂有利于将缀合物加工成可在药学上用于递送至作用位点的制剂。用于肠胃外施用的合适配方包括水溶性形式的缀合物的水溶液(例如水溶性盐)。另外,可以施用缀合物的混悬液(例如油性注射混悬液)。合适的亲脂性溶剂或载体包括脂肪油(例如芝麻油)或合成脂肪酸酯(例如油酸乙酯)或甘油三酯。水性注射混悬液可含有增加混悬液粘度的物质,包括例如羧甲基纤维素钠、山梨糖醇和葡聚糖。可选地,混悬液还可以含有稳定剂。脂质体也适用于封装缀合物以递送至肿瘤细胞。
[0151]
根据本发明的用于全身施用的药物配方可以配制用于肠内、肠胃外或局部施用。可以使用任何常见的局部配方,例如溶液、悬浮液、凝胶、软膏或油膏等。此类局部配方的制备描述于remington’s pharmaceutical sciences(gennaro ed,1995,mack publishing)中。对于局部施用,药物组合物还可以粉末或喷雾剂的形式施用,特别是气雾剂的形式。药物组合物可以通过吸入施用。对于吸入疗法,缀合物可以是适用于通过计量剂量吸入器施用的溶液或适合于干粉吸入器的形式。药物组合物也适合通过支气管灌洗施用。
[0152]
用于口服施用的合适配方包括硬或软明胶胶囊、丸剂、片剂,包括包衣片剂、酏剂、混悬剂、糖浆剂或吸入剂及其控释形式。
[0153]
本发明的ctxd缀合物适用于癌症的诊断、癌组织的可视化和癌症的治疗。所有这些用途都是基于缀合物选择性地结合癌组织/细胞的现象。此类细胞可以是过表达mmp-2蛋白的那些细胞。一旦缀合物与癌细胞结合,根据缀合物的辅基的功能,特异性结合适用于诊断目的、可视化或可杀死细胞(即治疗癌症)。诊断用途可能有助于确定或定位体内或上皮表面(皮肤或粘膜)上癌细胞/组织的存在,或有助于识别可能对使用ctxd受体作为靶向基序的特定治疗敏感的癌组织类型。如果缀合物具有可视化药剂作为辅基,则可以使癌组织可视化。可视化可能有助于区分癌细胞或组织与周围健康(非癌)细胞/组织,例如在荧光引导手术中。通过特定蛋白质和适当的辅基的缀合物对癌细胞和组织的诊断、可视化和治疗是本领域技术人员众所周知的。
[0154]
本发明的缀合物适用于诊断和治疗几乎所有类型的表达ctx结合位点的恶性肿瘤。这些癌症类型包括神经胶质瘤、星形细胞瘤、少突胶质细胞瘤、成神经管细胞瘤、脉络丛癌、室管膜瘤、脑膜瘤、胶质母细胞瘤、神经节瘤、嗜铬细胞瘤和转移性脑肿瘤、其他脑肿瘤、成神经细胞瘤、头颈癌、小细胞肺癌、乳癌、肠癌、胰癌、结肠癌、肝癌、肾癌、皮肤癌、肉瘤(超过30种)、骨肉瘤、横纹肌肉瘤、尤文氏肉瘤、癌、黑色素瘤、卵巢癌、宫颈癌、淋巴瘤、甲状腺癌、肛门癌、结直肠癌、子宫内膜癌、生殖细胞肿瘤、喉癌、多发性骨髓瘤、前列腺癌、视网膜
母细胞瘤、胃癌、睾丸癌和威尔姆斯肿瘤。本发明的缀合物尤其适用于治疗和诊断选自以下的癌症:乳癌、宫颈癌、结肠癌、室管膜瘤、尤文氏肉瘤、神经节神经胶质瘤、神经节瘤、神经胶质瘤、胶质母细胞瘤、胶质肉瘤、成神经管细胞瘤、脑膜瘤、成神经细胞瘤、黑色素瘤(原发性和转移性)、胰癌、嗜铬细胞瘤、前列腺癌、神经鞘瘤和小细胞肺癌。在我们的实验中,我们证明我们的ctxd特别高强度地摄取到乳癌、胶质母细胞瘤、黑色素瘤和胰癌细胞中,因此它们是根据本发明的最优选的癌症类型。
[0155]
本发明的缀合物适用于可视化几乎每种类型的表达ctx结合位点的恶性癌症。本发明的缀合物尤其适用于癌组织的可视化,其中该组织源自以下癌症:乳癌、宫颈癌、结肠癌、室管膜瘤、尤文氏肉瘤、神经节神经胶质瘤、神经节瘤、神经胶质瘤、胶质肉瘤、成神经管细胞瘤、脑膜瘤、成神经细胞瘤、黑色素瘤(原发性和转移性)、胰癌、嗜铬细胞瘤、前列腺癌、神经鞘瘤、小细胞肺癌;其中乳癌、胶质母细胞瘤、黑色素瘤和胰癌是根据本发明的最优选的癌组织。
[0156]
本发明进一步涉及治疗患有癌症的患者的方法。在这个意义上,术语“患者”应理解为任何哺乳动物,例如人类、羊、马、牛、猪、狗、猫、大鼠和小鼠。本发明特别适用于治疗患有癌症的人类患者。所述方法包括以有效剂量向所述患者施用根据本发明的缀合物。用于治疗癌症患者的缀合物具有适合于治疗所述癌症的治疗剂的辅基。在一个优选的实施方式中,用于治疗方法的缀合物是本发明的药物组合物的形式。
[0157]
根据本发明的优选实施方式,待用本发明的缀合物或药物组合物治疗的患者患有选自神经胶质瘤、胰癌、黑色素瘤和乳癌中的癌症。
[0158]
本发明进一步涉及一种制备本发明缀合物的方法。该方法至少包括以下步骤:
[0159]
a)提供根据权利要求1至5中任一项所述的氯毒素衍生物;
[0160]
b)可选地将接头基团与步骤a)的氯毒素衍生物结合;
[0161]
c)将辅基结合至步骤b)中形成的化合物的接头部分或在不存在接头的情况下直接结合至步骤a)的蛋白质。
[0162]
简言之,该制备方法的起始材料是本发明的氯毒素衍生物(即步骤“a)”)。由于这些蛋白质构成由构建蛋白质的常用氨基酸组成的简单氨基酸序列,因此可以使用现有技术中众所周知的方法和试剂来进行所述氯毒素衍生物的合成。
[0163]
制备方法的下一步是可选的,因为缀合物中接头的存在是可选的。即,如果待制备的缀合物是在氯毒素衍生物和辅基之间具有接头的缀合物,则必须进行所述步骤“b”。可以用本领域熟知的方法将接头附接至蛋白质。
[0164]
作为下一步骤“c”,将辅基连接至构建体,该构建体可以是不存在接头的氯毒素衍生物,或者是步骤“b”的结果的构建体。辅基与蛋白质的结合很大程度上取决于辅基本身。然而,构建此类构建体是本领域技术人员已知的。
[0165]
用于制备缀合物的方法可以进一步包括众所周知的步骤,如分离、纯化、分析等,所有这些步骤对于本领域蛋白质化学家来说通常是已知的。
[0166]
本发明进一步涉及一种用于癌组织可视化的方法,所述方法包含使待检查组织与本发明的缀合物接触的步骤,其中所述缀合物的辅基是适合癌组织可视化的可视化药剂。此类组织可以是过表达mmp-2蛋白的那些组织。
[0167]
如上详述,如果本发明缀合物的辅基是可视化药剂,则所述缀合物适用于使缀合
物的氯毒素衍生物部分所结合的那些组织可视化。通过执行该方法,如果氯毒素衍生物特异性结合至癌组织,则可以使所述癌组织可视化。通过这种方法,可以使肿瘤可视化,这对于切除所述肿瘤的手术过程有很大帮助。
[0168]
通过上述可视化方法,可以对患者体内的某一肿瘤进行定位。如果某一肿瘤类型的定位不确定或需要确认,则此方法很有帮助。使用本发明提供的可视化和定位工具,将在去除癌组织的手术步骤期间为医生提供支持。
[0169]
上述可视化方法的进一步有用的应用是检查患者以查明所述患者体内是否存在某种肿瘤。也就是说,本发明提供了一种诊断癌症的有用工具,其通过借助本发明的缀合物的选择性结合来检测癌组织。
[0170]
上述可视化方法的另一个有用的应用是定位肿瘤细胞,从而医生可以确定肿瘤是否已从患者体内完全切除。
[0171]
本发明进一步涉及嵌合抗原受体(car),其并入了根据本发明的氯毒素衍生物衍生的细胞外结构域。用氯毒素或类似毒素构建的car公开于wo 2017/066481a1国际专利申请中。关于含有氯毒素结构域的car的合成方法、特征和用途,请参阅该国际专利申请中本领域技术人员已知的信息。在基因改造的t细胞表面上表达car。car t细胞可以被重定向以特异性识别抗原性不同的肿瘤群体。
[0172]
简而言之,嵌合抗原受体(car)修饰的t细胞可以通过结合其特异的肿瘤相关抗原(taa)来特异性识别和杀死各种肿瘤细胞系。car是表达细胞外taa识别/靶向结构域和能够有效激活t淋巴细胞的细胞内效应结构域(通常是tcrζ(tcrζ)链)的跨膜嵌合蛋白,该细胞外taa识别/靶向结构域是根据本发明的氯毒素衍生物,其提供与分子靶标的特异性且有效的结合[june 2018]。如果t细胞在例如逆转录病毒或慢病毒转导之后具有由相应核酸编码的car,则t细胞可以表达car。
[0173]
根据本发明的一个实施方式,提供了一种编码嵌合抗原受体(即car)的核酸,该car至少包含以下构建单元:
[0174]
a)根据本发明的氯毒素衍生物;
[0175]
b)可选地在氯毒素衍生物和跨膜结构域之间的间隔子区;
[0176]
c)跨膜结构域;
[0177]
d)一个或两个共刺激结构域;
[0178]
e)信号结构域;
[0179]
其中所述氯毒素衍生物使得car在t细胞表面表达时能够将t细胞活性引导至癌细胞。
[0180]
根据该构建体,由本发明的核酸编码的car具有对应于本发明的氯毒素衍生物的细胞外氯毒素衍生物结构域。氯毒素衍生物形成细胞外结构域或作为细胞外结构域的一部分,该细胞外结构域用作细胞外识别结构域。其识别元件特异性地结合靶细胞表面上存在的分子。细胞外识别结构域通过铰链(也称为接头或间隔子)及其相关的跨膜结构域连接到细胞内效应结构域。也就是说,跨膜结构域将car锚定在所述t细胞的膜上。胞内结构域包含至少一个共刺激结构域和信号结构域,其功能是本领域技术人员众所周知的。
[0181]
细胞外结构域,换句话说,细胞外识别结构域,可以包含一个或多个相同或不同的本发明的氯毒素衍生物。根据优选的实施方式,car构建体包含一种氯毒素衍生物。
[0182]
氯毒素衍生物优选地选自具有seq id no:3至seq id no:18和seq id no:36至seq id no:42(优选seq id no:4或seq id no:42)所示序列的任一个的氯毒素衍生物。
[0183]
由本发明的核酸编码的car构建体可选地包含在氯毒素衍生物和跨膜结构域之间的间隔子区。对于本领域技术人员显而易见的是,如果跨膜结构域和氯毒素衍生物之间需要有一定的空间排列以使car构建体正常发挥作用,则需要间隔子区。间隔子区的组成和长度决定了抗原识别结构域的移动性以及在t细胞和靶标之间的物理距离。间隔子区可包含长度为5至300个残基的氨基酸。例如,间隔子区可包含igg(igg1或igg4)或cd8铰链区。
[0184]
由本发明的核酸编码的car构建体的跨膜结构域优选地选自cd4跨膜结构域或其变体、cd8跨膜结构域或其变体、cd28跨膜结构域或其变体、和cd3ζ跨膜结构域或其变体[fujiwara 2020]。在与跨膜结构域相关的术语“变体”下,蛋白质应理解为与原始蛋白质相比具有1至5个氨基酸修饰(例如取代、插入、缺失),前提是半胱氨酸残基未被修饰。
[0185]
由本发明的核酸编码的car构建体的共刺激结构域优选地选自cd28共刺激结构域或其变体、4-1bb共刺激结构域或其变体和ox40共刺激结构域或其变体[zhong 2010]。在与共刺激结构域相关的术语“变体”下,蛋白质应理解为与原始蛋白质相比具有1至5个氨基酸修饰(例如取代),前提是半胱氨酸残基未被修饰。
[0186]
由本发明的核酸编码的car构建体的信号结构域优选地选自cd3ζ信号结构域或其变体。在与信号结构域相关的术语“变体”下,蛋白质应理解为与原始蛋白质相比具有1至5个氨基酸修饰(例如取代),前提是半胱氨酸残基未被修饰。
[0187]
共刺激结构域和信号结构域之间可以具有短的(即少于十个氨基酸)接头氨基酸序列。
[0188]
由本发明的核酸编码的car构建体的氯毒素衍生物使得car在t细胞表面上表达时能够将t细胞活性重定向至癌细胞,优选重定向至胶质母细胞瘤细胞。
[0189]
本发明的核酸可以通过本领域技术人员已知的分子克隆的标准技术来制备并组装成完整的编码序列。
[0190]
本发明进一步涉及包含编码本发明的car构建体的核酸分子的载体。载体可以是质粒、核酸(rna或dna)分子,其用作携带另一个细胞中外源遗传物质的载具。在当前情况下,所述外源遗传物质是编码所述car构建体的本发明的核酸,并且所述其他细胞是适合于所述目的某种免疫细胞(合适的免疫细胞是自体人类t细胞、自体人类cd4 辅助细胞、自体人类cd8 细胞毒性t细胞、自体人类cd4 辅助t细胞和cd8 细胞毒性t细胞以任何比例的混合物、同种异体人类t细胞、同种异体人类cd4 辅助t细胞、同种异体人类cd8 细胞毒性t细胞、任何比例的同种异体人类cd4 辅助t细胞和cd8 细胞毒性t细胞的混合物、自体原代人类自然杀伤(nk)细胞、同种异体原代人类自然杀伤(nk)细胞、nk-92细胞系的同种异体细胞、自体人类单核细胞、自体人类巨噬细胞、同种异体人类单核细胞、同种异体人类巨噬细胞)。该载体适合于转染所述免疫细胞,并从而将本发明的核酸分子引入所述免疫细胞中。此后,经转染的免疫细胞将能够在其表面上表达所述car构建体。可以通过电穿孔或转染试剂(例如lipofectamine)促进载体的进入。病毒载体也可以促进外源遗传物质进入宿主细胞及其整合到宿主细胞遗传物质中,在这种情况下,该过程称为转导而不是转染。
[0191]
本发明进一步涉及一种人类细胞的群体,其中所述细胞:i)被包含表达盒的rna或dna载体转染,所述表达盒包含本发明的核酸,其中转染在体内或离体进行;或ii)被包含表
达盒的病毒载体转导,所述表达盒包含本发明的核酸,其中转导在体内或离体进行。在转导的情况下,病毒载体优选是逆转录病毒或慢病毒载体,因为这些类型的病毒载体被广泛使用并且被证明适用于所述转导目的。在转导的情况下,本发明的人类细胞的群体被病毒载体转导,所述病毒载体优选是逆转录病毒或慢病毒载体,所述载体包含表达盒,所述表达盒包含本发明的核酸。此处,载体是病毒载体,在这种情况下,使用术语转导而不是转染。这种病毒转导的人类细胞的群体将能够在转导细胞的表面上表达所述car构建体。所述转导在体内或离体进行。
[0192]
对于本领域技术人员显而易见的是,术语“体内”在本文中是指在存在于活人体内的细胞上进行转染或转导。对于本领域技术人员显而易见的是,术语“离体”在本文中是指在从活人体中提取的细胞上进行转染或转导,这些细胞随后可以被引入回所述活人体内,或甚至进入另一个活人体。所述人类细胞应选自由以下人类细胞类型组成的列表:自体人类t细胞、自体人类cd4 辅助t细胞、自体人类cd8 细胞毒性t细胞、任何比例的自体人类cd4 辅助t细胞和cd8 细胞毒性t细胞的混合物、同种异体人类t细胞、同种异体人类cd4 辅助t细胞、同种异体人类cd8 细胞毒性t细胞、任何比例的同种异体人类cd4 辅助t细胞和cd8 细胞毒性t细胞的混合物、自体原代人类自然杀伤(nk)细胞、同种异体原代人类自然杀伤(nk)细胞、nk-92细胞系的同种异体细胞、自体人类单核细胞、自体人类巨噬细胞、同种异体人类单核细胞、同种异体人类巨噬细胞。
[0193]
上述列出的细胞对于本发明的目的是有用的,因为
[0194]
i)已证明car t细胞疗法的功效最常归因于cd8 细胞毒性t细胞,并且cd4 辅助t细胞以其辅助功能而公知并且通过细胞因子产生增强cd8 t细胞的活性来内在地激发细胞溶解活性[zhang 2020]。
[0195]
ii)已证明基于嵌合抗原受体修饰的自然杀伤(car-nk)细胞的免疫疗法是实体瘤或血液恶性肿瘤的癌症免疫疗法背景下的一种有前途且先进的替代[marofi 2021]。
[0196]
iii)nk-92细胞系来源于非霍奇金淋巴瘤患者,并且其特征与从外周血中获得的活化的原代人类nk细胞相似。然而,原代细胞的离体分离和扩增具有挑战性。因此,nk-92细胞系提供了一种有价值的替代,因为这些细胞可以在补充il-2的环境中轻松扩增。
[0197]
iv)此外,已证明嵌合抗原受体修饰的巨噬细胞可以浸润实体瘤组织,并且与肿瘤微环境中的几乎所有细胞组分相互作用(包括肿瘤细胞、免疫细胞如t细胞、nk细胞、树突状细胞、和其他常驻非免疫细胞)[mukhopadhyay 2020]。单核细胞被认为是存在于血液中的巨噬细胞的前体。
[0198]
所述人类细胞的群体被包含表达盒的所述载体转染或转导,所述表达盒包含本发明的核酸。本发明的人类细胞的群体携带表达盒形式的本发明的核酸。可以通过从待治疗的人类患者分离合适的细胞、用包含含有所述核酸的表达盒的载体转染或转导这些合适的人类细胞来产生这些人类细胞。转染或转导在体内或离体进行。
[0199]
本发明进一步涉及一种治疗患者中癌症的方法。该方法涉及施用本发明的人类细胞的群体的步骤。根据本发明,也可以施用本发明的不同人类细胞的群体的组合来治疗患者中癌症。
[0200]
治疗癌症的方法涉及例如施用由包含表达盒的载体转导的自体或同种异体人类t细胞群体的步骤,所述表达盒包含本发明的核酸。
[0201]
治疗癌症的方法涉及例如施用由包含表达盒的载体转导的自体或同种异体人类自然杀伤(nk)细胞群或nk-92细胞系的步骤,所述表达盒包含本发明的核酸。
[0202]
所述方法涉及施用由包含表达盒的载体转导的自体或同种异体人类单核细胞或巨噬细胞群的步骤,所述表达盒包含本发明的核酸。
[0203]
我们的方法(发明过程)
[0204]
我们的目标是寻找对mmp-2具有改进的亲和力和选择性的新ctx衍生物,用于区分肿瘤细胞和健康组织细胞。背景科学强烈表明mmp-2是ctx的真正结合蛋白靶标,尽管该发现之前并未通过重组产生的mmp-2的下拉测定得到证实[veiseh 2007]。因此,我们首先建立了一种定量流式细胞术方法,即“磁珠测试”,用于评估ctx与重组生产的纯化mmp-2蛋白的结合。使用这项新颖的测试,我们证实荧光团标记的ctx特异性结合到覆盖有mmp-2的珠上,所述mmp-2通过抗mmp-2抗体锚定在珠上。通过测量珠上积累的荧光强度来检测这种结合,可以通过用标记的ctx增加温育浓度而饱和,并且通过用过量的未标记ctx温育而完全消除(“置换”),从而表明它是与mmp-2蛋白上的ctx受体的特异性结合。
[0205]
已经确定单独纯化的mmp-2(即不一定在蛋白质复合物中)特异性结合ctx后,我们启动了一项筛选计划,以筛选更有效的mmp-2结合ctxd。为此,我们应用了设计师毒素平台技术[takacs et al.,2009]。该技术利用现有的毒素蛋白序列以创建在丝状噬菌体m13表面上展示的毒素蛋白文库,以使用由g.p.smith于1985[smith,1985]发明的称为噬菌体展示的方法,通过迭代选择轮次来识别高亲和力粘合物。我们设计并构建了一个由源自32个蝎子物种的1,376,254个置换衍生物的文库,其保留了ctx二硫键的模式。所展示的蛋白质通过gsassa(肽序列)接头在其c末端与p3外壳蛋白融合。我们在人类重组mmp-2上筛选该文库并鉴定出一种新颖化合物(下文称为ctxd1或seq id no:17),其比ctx更强烈地结合mmp-2。
[0206]
为了定量表征噬菌体上展示的蛋白质结合的相对强度,我们开发了一种新的基于流式细胞术的测定,名为“钴珠测试”或简称“co-珠测试”(尚未发表)。该测定基于使用工厂预制的钴涂覆珠(dynabeads-来自thermofisher scientific的his-tag isolation&pulldown),旨在根据固定化金属亲和色谱(imac)原理分离his标记蛋白。这些珠能够将不同的his标记的靶蛋白固定在其表面上,并从而在针对噬菌体的m13抗原进行荧光染色后,评估展示结合到靶蛋白的噬菌体颗粒的配体肽的量。这种方法还能够研究合成或重组生产的纯化且荧光团标记的配体肽与各种his-标记的靶蛋白的结合。实施例5中描述了这种基于流式细胞术的新颖方法的细节;实施例7中描述了co-珠测试中测试的噬菌体的制备。
[0207]
为了揭示结构活性关系(sar),借助co-珠测试,我们从ctxd1序列开始进行有意识的诱变研究,并与作为参考的ctx展示噬菌体相比,量化了不同ctxd展示噬菌体的mmp-2结合的优劣(“相对结合”)。在用等噬菌体浓度的表达ctxd和ctx的噬菌体温育并且以用于m13抗原检测的染色后,通过相对于来自未用mmp-2涂覆的珠的荧光信号测量mmp-2涂覆珠上m13-相关荧光增加的相对量,评估了相对结合。表i中呈现了这些sar研究中研究的氨基酸序列及其结果。
[0208]
表i:co-珠测试中ctx(seq id no:1)、mctx(seq id no:2)和各种ctxd(seq id no:3至seq id no:34)展示噬菌体的氨基酸序列和相对结合强度。
[0209][0210]
seq id no:19至seq id no:34中列出了实质上并不比ctx本身更强的结合剂的ctxd蛋白。序列中间的
“‑‑”
仅存在使序列彼此比齐的明显间隙。“n=”指相对mmp-2结合的测量次数,“相对mmp-2结合”是基于进行n次实验的平均值。由seq id no:4编码的蛋白质在本说明书中称为ctxd5并且由seq id no:17编码的蛋白质称为ctxd1。
[0211]
由于单赖氨酸ctxd蛋白可能有利于缀合产物的目的,为了标记或靶向递送,首先我们通过替换三个赖氨酸残基中的两个来研究ctxd1的各种单赖氨酸衍生物。令人惊奇的是,在ctxd1的单赖氨酸衍生物中,我们发现了七种衍生物(seq id no:4、seq id no:10、seq id no:11、seq id no:12、seq id no:13、seq id no:14、seq id no:16),其是比ctxd1
强得多的mmp-2结合剂。接下来,我们的目标是确定观察到的优异mmp-2结合强度所必需的最小蛋白质长度,同时保留二硫键模式。因此,我们选择ctxd5进行进一步修饰,并研究n末端和c末端截短(缺失突变)直到第一个半胱氨酸残基的影响。c末端逐步截短显然没有消除ctx衍生物的优异结合潜力,直到最后一个半胱氨酸后去除谷氨酰胺,如图3所示。在该图中,条形图显示了ctx和不同ctxd5衍生物与mmp-2和nrp1靶蛋白的不同结合强度和选择性,如使用co-珠测试的噬菌体展示检查所示。该实验旨在研究ctxd5的c末端修饰的影响,因此,还指示了从测试的ctx和ctxd5衍生蛋白的最后一个半胱氨酸残基开始的不同c末端序列。对照珠(cont)未暴露于噬菌体,但涂覆有靶蛋白并经受了整个染色程序。其他珠暴露于2.6x 10
14
个噬菌体颗粒/ml的均匀噬菌体浓度的指示肽展示噬菌体。
[0212]
我们使用c末端截短突变体的定量噬菌体结合研究也测量了与nrp1蛋白质的结合,因为mcgonigle et al.[mcgonigle 2019]的文章建议rctx的c末端部分在与nrp1结合中起关键作用。结果表明,噬菌体展示的ctx对mmp-2和nrp1表现出大致相同的结合,但ctxd5及其截短突变体对mmp-2具有选择性,并且不与nrp1结合,除非c末端部分被截短直至半胱氨酸残基。然而,当缺失了半胱氨酸之后的所有氨基酸时,nrp1结合重新出现并达到与相对减少的mmp-2结合(图3)或与ctx的nrp1结合几乎相同的水平。因此,这些噬菌体展示结果表明,除了以半胱氨酸结尾的衍生物外,ctxd5及其截短衍生物不仅是比ctx对mmp-2的更强结合剂,而且与对nrp1的结合相比,对mmp-2具有选择性。通过研究重组产生的纯ctxd5蛋白物质证实了从噬菌体展示研究的该预测(见下文)。
[0213]
缺失ctxd5(即seq id no:4)的一个或两个n末端氨基酸分别产生了seq id no:6和seq id no:8的氯毒素衍生物(参见表i)。然而,这些突变并没有显著改变所得氯毒素衍生物的结合强度。
[0214]
缺失ctxd1(即seq id no:17)的n末端丙氨酸产生了seq id no:18的氯毒素衍生物。这种突变也没有显著改变所得蛋白质的结合强度。
[0215]
基于从噬菌体展示化合物的靶蛋白结合的定量评估获得的sar结果,鉴定出一组氯毒素衍生物,它们在与mmp-2的结合方面比ctx或mctx实质更有效,并且在靶蛋白选择性方面更具有选择性,与正常细胞/组织相比,这可能会带来对肿瘤细胞/组织的增强选择性。
[0216]
为了确认从噬菌体展示研究预测的蛋白质的特征,重组生产并作为纯化的氯毒素衍生物获得了ctxd5。使用ctxd5作为先导化合物,我们与单独或缀合形式的ctx和/或mctx进行比较,表征了其靶蛋白和细胞结合特性。然而,这种先导化合物具有中等的水溶性,这种水溶性可以通过各种缀合进一步降低,并因此可能是配制用于肠胃外使用的诊断或治疗药物制剂的阻碍因素。
[0217]
因此,我们研究了先导化合物seq id no:4(ctxd5)和seq id no:10的故意溶解性增强突变的影响。基于已发表的科学文献数据[trevino2007],我们假设分别用sss和es序列替换从#7和#12氨基酸位置开始的ftt和qt序列,以及在c末端区域中应用聚精氨酸序列可能会显著提高所得ctxd蛋白的溶解性,同时保留先导化合物的增强的mmp-2亲和力。为了评估新的溶解性增强突变体的mmp-2亲和力,如上所述,我们定量了不同溶解性增强ctxd展示噬菌体相对于ctx展示噬菌体的mmp-2结合优越性(“相对mmp-2结合”)。这种关于相对mmp-2结合的溶解性增强突变体噬菌体展示研究的结果显示在表ii中。
[0218]
表ii:通过突变下划线氨基酸(即溶解性簇和c末端簇)衍生自ctxd seq id no:4
和seq id no:10的噬菌体展示的ctxd变体的氨基酸序列和相对结合强度。
[0219][0220]
结果表明,所有设计的溶解性增强突变体都保留了高mmp-2结合,因为它们都表现出比ctx高大约3倍或稍高的结合强度。因此,我们选择了包含所有测试的溶解性增强突变(seq id no:42)的蛋白质用于测试物质生产作为次要先导化合物,并将其表示为ctxd8。使用ctxd5作为主要先导化合物并且使用ctxd8作为次要先导化合物,我们表征了与单独或缀合物形式的ctx和/或mctx进行比较,它们的靶蛋白和细胞结合特性。
[0221]
用于这些研究的化学工具箱包括以下化合物。
[0222]
化学工具箱
[0223]
1.非缀合的ctx衍生物:
[0224]
图1示出了一些非缀合的ctx变体/衍生物。
[0225]
合成的ctx购自iris biotech gmbh(德国)。如实施例1中所述重组产生rctx和mctx。
[0226]
2.非缀合的ctxd衍生物:
[0227]
如实施例1中所述重组产生ctxd5和ctxd8。
[0228]
3.缀合的ctx和ctxd衍生物
[0229]
以下缀合产物是购买的或通过与上述非缀合的ctx和氯毒素衍生物进行缀合化学反应而生产的。
[0230]
3.1.花青-5(~cy5)缀合物
[0231]
在我们的研究中,我们使用了ctx-cy5、rctx-cy5、mctx-cy5、ctxd5-cy5和ctxd8-cy5。经hplc分离选择,它们全部均为单缀合ctx衍生物。ctx-cy5和rctx-cy5是在ctx的三个赖氨酸残基之一上随机单缀合的分子混合物。在ctxd5、ctxd8和mctx的情况下,分离并使用了仅在一个赖氨酸残基处连接的缀合物。如实施例2中所述,缀合反应应用花青5nhs酯。
[0232]
3.2.alexa 488(-a488)缀合物
[0233]
将ctx的ctx-a488缀合物用作荧光标签的配体,在足够不同的激发/发射波长下工作,以便能够比较评估不同cy5标记和未标记的ctx和ctxd配体的置换效力(亲和力),而不会干扰其他配体(cy5)荧光团。a488和cy5的激发/发射最大值分别为495/519和647/665。
[0234][0235]
3.3.以单甲基澳瑞他汀f(mmaf)作为有效载荷的可切割细胞抑制缀合物
[0236]
广泛使用的缬氨酸-瓜氨酸-对氨基苄氧羰基(vc-pabc)二肽接头已被普及作为一种保持有效载荷药物与特异性靶向抗体稳定共价附接的方式,这些特异性靶向抗体可以优先被溶酶体降解途径的细胞内蛋白酶组织蛋白酶b切割[doronina 2008]。为了证明ctxd5与mctx相比的这种靶向效用,我们合成了通过戊二酰接头附接至靶向蛋白的可切割细胞抑制缀合物。以1x缀合和2x缀合的形式合成了mctx-戊二酰-缬氨酸-瓜氨酸-对氨基苄氧基羰基-mmaf(mctx-g-vc-pab-mmaf)和ctxd5-戊二酰-缬氨酸-瓜氨酸-对氨基苄氧基羰基-mmaf(ctxd5-g-vc-pab)-mmaf),即mctx(-g-vc-pab-mmaf)2和ctxd5(-g-vc-pab-mmaf)2,在最终纯化步骤中收集。第二缀合位点在n末端胺。实施例4中描述了g-vc-pab-mmaf缀合物的合成。
[0237]
图2中示出了ctxd5-g-vc-pab-mmaf缀合物的结构。该构建体是本发明缀合物的优选实例。即,氯毒素衍生物部分是ctxd5(seq id no:4)。该缀合物具有两个接头,即戊二酰接头和组织蛋白酶可切割的接头。它进一步具有间隔子。该缀合物的辅基是单甲基澳瑞他汀f(mmaf)。
[0238]
3.4.生物素缀合的ctx和ctx衍生物
[0239]
将生物素化的ctx和ctxd5用于细胞化学和组织化学应用。随机单生物素化的ctx购自iris biotech gmbh(德国)。单生物素化的ctxd5通过常规生物素化程序产生,并且通过hplc纯化在唯一赖氨酸残基处的单缀合物并冻干,如实施例3中所述。
[0240]
ctxd5与ctx作为靶向分子的比较分析
[0241]
使用上述详细化学工具箱中的化合物,我们研究了ctxd5、ctxd8和相关示例缀合物的关键特征,并与ctx进行比较,并在某些方面与mctx及其缀合物进行比较。
[0242]
为了研究测试物质与选定靶蛋白的结合亲和力,除了co-珠测试之外,我们还建立了另一种基于流式细胞术的测定法,即“磁珠测试”。与co-珠测试相比,使用将靶蛋白固定在珠表面上的特异性抗体的该测试有优点也有缺点。其优点包括更高的灵敏度,即在较低的有效浓度下工作,以及非特异性结合水平不显著,无需任何阻断温育步骤。缺点是它不能应用于噬菌体展示蛋白结合研究或不能应用于标记配体与广泛的固定化靶蛋白结合的统一研究。将磁珠测试用于研究两种不同测试模式(即结合和置换)下配体的亲和力。为了评估荧光团标记的配体与ctx受体的亲和力,应用了“结合模式”,由此在用各种标记的配体浓度温育后从荧光强度直接评估了结合的配体的量。为了评估未标记的配体与ctx受体的亲和力,应用了“置换模式”,由此在与测试的未标记的配体预温育和共温育后,将珠暴露于固定浓度的标记配体(1μm ctx-cy5),并且测量结合的荧光。通过表征测试配体的百分之五十
置换浓度(ic
50
值)的浓度-置换研究来估计未标记配体的相对亲和力。实施例6中描述了用于比较测量标记和未标记的ctx和ctxd与mmp-2和nrp1蛋白的结合亲和力的磁珠测试的详细协议。
[0243]
与ctx、rctx和mctx相比,ctxd5和ctxd8的mmp-2结合亲和力
[0244]
通过置换1μm标记的配体ctx-cy5获得的未标记配体的浓度-响应研究,比较了ctxd5、ctxd8和ctx的结合亲和力(图4)。图4示出了在磁珠测试中,针对1μm作为置换配体的ctx-cy5,ctx、ctxd5和ctxd8的浓度-置换关系,指示了它们对mmp-2蛋白的亲和力之间的差异。结果表示为比较两种化合物的2个独立实验的平均值
±
sd,以及对平均值的s形曲线拟合。
[0245]
还通过在磁珠测试中从mmp-2置换1μm ctx-a488来比较了ctxd5、ctxd8和ctx的结合亲和力。结果示于表iii中。
[0246]
表iii:在磁珠测试中通过从mmp-2置换ctx-a488(1μm)测量的未标记和标记的ctxd5和ctxd5衍生物的亲和力
[0247]
置换剂化合物ic50(μm)ctxd50.22ctxd5-cy50.18ctx0.68ctx-cy50.57rctx0.68rctx-cy50.42mctx0.77mctx-cy50.40ctxd80.18ctxd8-cy50.18
[0248]
在后面的实验中,也与rctx和mctx进行了比较。标记的ctx结合强度被所有五种配体以浓度依赖性方式置换。抑制遵循s形浓度-响应关系并达到完全置换,表明五种蛋白质配体有共同的结合位点。然而,ctxd5和ctxd8置换标记的配体ctx-cy5的能力是ctx的4.4倍,ic
50
值分别为0.16μm、0.16μm和0.71μm(见图4)。根据ctx-a488置换测试,rctx和mctx的ic
50
值与ctx没有实质差异,ic
50
值分别为0.68μm、0.77μm和0.68μm。因此,结果证实了与ctx、rctx和mctx相比,ctxd5和ctxd8的mmp-2结合亲和力几乎同样较高,正如从噬菌体展示研究所预测的那样。
[0249]
缀合衍生物ctxd5、ctx和mctx的mmp-2结合亲和力
[0250]
通过在磁珠测试中这些标记的配体与mmp-2的结合的浓度-响应研究,比较了ctxd5-cy5、ctxd8-cy5和ctx-cy5的结合亲和力(图5)。该图显示了磁珠测试中,ctx-cy5、ctxd5-cy5和ctxd8荧光团标记的配体的mmp-2结合浓度-荧光关系,表明了这些荧光团标记的配体与mmp-2蛋白的亲和力之间的差异。结果表示为比较三种化合物的三个独立实验的平均值
±
sd,以及对平均值的s形曲线拟合。浓度-响应关系在s形曲线上拟合良好,并在相似水平达到饱和,表明它们与mmp-2上大约相同数量的结合位点结合。ctxd5-cy5和ctxd8-cy5的效力比ctx-cy5强3.7倍和3.1倍,ec
50
值分别为0.15μm、0.18μm和0.56μm。这些结果表
明,ctxd5、ctxd8和ctx的缀合配体均保留了非标记蛋白质的亲和力。该结论也在置换研究中得到了证实,其中ctx-a488(1μm)是标记的配体,并且ctxd5、ctxd8、ctxd5-cy5和ctxd8-cy5的ic
50
值分别为22μm、18μm、18μm和18μm。为了比较,还研究了ctx、rctx和mctx的未标记的和cy5-标记的衍生物(参见表iii)。结果表明,ctx、rctx和mctx的mmp-2亲和力没有显著差异,并且它们的cy5缀合物表现出相似或稍高的亲和力,在标记的和未标记的蛋白质之间观察到了最大差异,其中mctx-cy5的ic
50
值为0.40μm,相比之下,mctx的ic
50
值为0.77μm。
[0251]
在使用ctx-cy5作为置换配体的置换研究中,也证实了ctxd5的细胞抑制缀合物(即ctxd5-g-vc-pab-mmaf和ctxd5(-g-vc-pab-mmaf)2)的mmp-2结合亲和力的保留。ctxd5、ctxd5-g-vc-pab-mmaf和ctxd5(-g-vc-pab-mmaf)2的ic
50
值相似,即分别为0.20μm、0.23μm和0.22μm。
[0252]
与ctx相比,ctxd5和ctxd8的靶蛋白选择性的变化
[0253]
使用co-珠测试,我们研究了ctx-cy5、ctxd5-cy5和ctxd8-cy5与一组靶蛋白的结合,所述靶蛋白已被建议作为ctx的直接或间接结合伴侣。该组包括his-标记的蛋白mmp-2、mmp-9、mmp-14、timp-2、avβ3整合素、anx2、nrp1、clc3(氯离子通道)和人类血清白蛋白(hsa),后者作为一种阴性对照。结果如图6所示。此处,条形图显示了ctx-cy5、ctxd5-cy5和ctxd8-cy5标记的测试物质(均为1μm)与各种假定的靶蛋白的不同结合强度,如co-珠测试中通过珠结合荧光强度测量的。柱三联体代表未涂覆任何靶蛋白但用酪蛋白封阻的对照珠(cont),所有其他靶蛋白涂覆的珠均涂覆有mmp-2、nrp1、mmp-9、timp-2、mmp-14、anx2、avβ3整合素(int)、人类血清白蛋白(hsa)和clc3氯离子通道。结果呈现为三个实验的平均值
±
sd。图6所示结果表明,在1μm的测试浓度下,ctx-cy5以大致相同的强度与mmp-2和nrp1结合,并且它还表现出较弱但明显的结合mmp-9、timp-2和clc3。然而,ctx-cy5与mmp-14、avβ3整联素、anx2和hsa的结合可以忽略不计。相比之下,ctxd5-cy5和ctxd8-cy5与mmp-2的结合强度比ctx-cy5强至少3倍,但它们与测试组中除clc3和timp-2之外的所有其他蛋白质的结合可以忽略不计。即使它们与clc3和timp-2的轻微结合也明显弱于ctx-cy5。两种先导化合物的靶蛋白组结合和选择性特征在定性和定量上似乎是相同的。由于ctx-cy5对nrp-1具有显著的亲和力,我们在磁珠测试中比较了ctx-cy5和ctxd5-cy5的结合浓度-响应关系。结果如图7所示。此处,该图显示了ctx-cy5荧光团标记的配体的nrp1结合浓度-荧光关系,以及在磁珠测试中ctxd5-cy5与nrp1没有任何明显结合。结果表示为比较两种化合物的两个独立实验的平均值
±
sd,以及对ctx-cy5相对荧光强度的平均值与表征ctx-cy5与nrp1的亲和力的计算ec
50
值的s形曲线拟合。图7中描绘的结果显示,ctx-cy5以浓度依赖性方式与nrp1结合,ec
50
值为0.41μm,而ctxd5在高达10μm测试浓度时根本未显示出nrp1结合。在ctx-cy5置换研究中也证实了未标记的ctxd5和ctxd8与nrp1缺乏结合(未示出)。
[0254]
与ctx-cy5和mctx-cy5相比,ctxd5-cy5和ctxd8-cy5用于肿瘤细胞选择性染色的效用
[0255]
我们研究了较高的mmp-2结合亲和力和选择性如何转化为肿瘤细胞相对于非肿瘤细胞的细胞摄取效力和选择性。为此,我们研究了一些有代表性的肿瘤细胞系,以通过荧光显微镜和图像分析进行定性和半定量表征;并通过流式细胞术进行定量表征。
[0256]
细胞培养物图像结果
[0257]
使用imagexpress nano自动成像系统研究了在37℃下用mctx-cy5或ctxd5-cy5(2
μm)温育1小时的贴壁培养物中人类u251mg胶质母细胞瘤细胞和hdfa成纤维细胞的荧光显微图像,并且通过metaxpress软件(molecular devices)进行分析。为了可视化细胞体和细胞核,培养物分别用钙黄绿素am(invitrogen#c1430)和hoechst 33342(life technologies#h3570)进行染色。结果表明,mctx-cy5和ctxd5-cy5均被细胞摄取,并表现出wiranowska et al.[wiranowska 2011]描述的特征性细胞内分布,即核周大颗粒定位与胶质母细胞瘤细胞中网格蛋白介导的内吞作用和跨高尔基体积累一致,但弥漫性细胞质分布与成纤维细胞中的小胞饮作用一致。半定量分析显示,胶质母细胞瘤细胞对两种标记的ctxd的摄取量高于成纤维细胞,两种细胞类型中ctxd5-cy5的摄取量均高于mctx-cy5,并且胶质母细胞瘤中的ctxd5/mctx摄取比率也高于成纤维细胞。
[0258]
通过流式细胞术分析
[0259]
实施例8中给出了细胞摄取的流式细胞术研究的详细协议。简而言之,将测试的细胞与活力标志物(po-pro-1染料)和cy5-标记的ctx、mctx、ctxd5或ctxd8一起温育(双重染色)。在基于高po-pro-1摄取的门控非活细胞后,将cy5-缀合蛋白的摄取测量为相对于cy5蛋白未染色细胞的中值荧光强度(δmfi)。本研究纳入了一组代表性肿瘤细胞系,包含人类胶质母细胞瘤(u251 mg和u87 mg)、胰癌(panc-1)、黑色素瘤(a375)和乳癌(sk-br)细胞,这些细胞在之前的研究中已被分类为“ctx阳性”[lyons2002]。此外,据报道,还研究了“ctx阴性”恶性肿瘤细胞系te 671人类横纹肌肉瘤[soroceanu 1998]和正常非肿瘤细胞,即大鼠星形胶质细胞、人类真皮成纤维细胞(hdfa)和人类脐静脉细胞(huvec),以揭示在肿瘤选择性方向的改变。首先,我们使用荧光团标记的ctxd5和ctx对u251 mg和panc-1细胞进行了比较浓度-摄取研究。结果表明,在两种细胞系中,ctxd5-cy5的摄取效力是ctx-cy5的四倍,即同等有效浓度比ctx-cy5低4倍(图8)。该图显示了通过流式细胞术测量的,在细胞染色强度测试中ctx-cy5和ctxd5-cy5荧光团标记配体的细胞摄取浓度-荧光关系。数据表示为n=2和n=3实验的平均值
±
sd,其比较了两种化合物在两种恶性肿瘤细胞系中的染色强度:u251和panc-1。基于浓度-摄取关系,选择300nm作为固定测试浓度,并且在选定细胞系组中,在同时比较实验中研究了ctxd5-cy5、ctx-cy5和mctx-cy5的缀合蛋白摄取。结果显示,“ctx阳性”肿瘤细胞(胶质母细胞瘤、黑色素瘤、胰癌和乳癌细胞)摄取了相对大量的标记ctx、mctx和ctxd5;而“正常细胞”和“ctx阴性”横纹肌肉瘤细胞系的摄取则少得多(见表iv)。
[0260]
表iv:各种肿瘤和正常细胞对ctxd5-cy5和ctx-cy5的细胞摄取
[0261]
[0262][0263]
摄取是δmfi-δ中值荧光强度-相对于cy5-蛋白未染色细胞的荧光。肿瘤细胞的行是细胞系u87、u251、a375、panc-1和sk-br。lyons et al.[lyons 2002]分类为ctx阴性的肿瘤细胞系是细胞系te 671。
[0264]
所有细胞类型对ctxd5-cy5的摄取均高于ctx-cy5。然而,ctxd5/ctx摄取比率表明,ctxd5被摄取到肿瘤细胞中的强度是ctx的2.4-3.5倍,但进入正常细胞的强度仅是ctx的1.1-1.9倍,这清楚地表明,荧光团标记的ctxd5与标记的ctx相比不仅更强地染色肿瘤细胞,而且与正常细胞相比,它对所研究的肿瘤细胞也更具选择性。在所有测试的细胞系中,mctx-cy5的细胞摄取强度与ctx-cy5的细胞摄取强度没有显著差异。
[0265]
为了比较两种标记的先导化合物ctxd8-cy5和ctxd5-cy5的细胞摄取,我们进行了第二系列实验。该比较研究的结果如表v所示。
[0266]
表v:各种肿瘤和正常细胞对ctxd8-cy5和ctxd5-cy5的细胞摄取的比较
[0267][0268][0269]
摄取是δmfi-δ中值荧光强度-相对于未染色细胞的荧光。
[0270]
结果表明,这项更新的研究中ctxd5-cy5的摄取强度与之前的研究非常相似(参见表iv)。此外,ctxd8-cy5的摄取强度与ctxd5-cy5的摄取强度几乎相同,这表明了非常相似的细胞摄取以及肿瘤相比于非肿瘤的选择性概况。
[0271]
ctxd5用于化疗药物靶向细胞内递送的用途
[0272]
为了研究ctxd5相对于与化疗药物缀合的mctx的改进的靶向效力,我们比较了两种靶向蛋白ctxd5和mctx的细胞内可切割的mmaf缀合物的增殖抑制效力。测试了ctxd5和mctx与-gvc-pab-mmaf的单缀合物和双缀合物形式。实施例9中描述了研究协议。结果表明,单缀合的ctxd5-g-vc-pab-mmaf的ic
50
为585nm,对u251 mg细胞增殖的抑制作用是单缀合的
mctx-gvc-pab-mmaf的2.4倍。双缀合的ctxd5-(gvc-pab-mmaf)2的ic
50
为235nm,其效力是双缀合的mctx-(gvc-pab-mmaf)2的9.7倍。与最低有效浓度相比,两种靶向蛋白之间的差异更为突出,因为ctxd5双缀合物化合物的最低有效浓度为10nm,而更好的mctx缀合物(即mctx单缀合物)具有1000nm的最低有效浓度,这意味着ctxd5化疗缀合物在远更低的浓度水平下开始具有所需的治疗效应。
[0273]
ctxd8用于car t细胞疗法效用的体外研究
[0274]
为了研究ctxd8或典型ctx识别域重定向效应细胞是否具有更好的诱导靶细胞细胞溶解的潜力,我们生成了编码ctxd8-car或ctx-car的逆转录病毒载体,并且转导了源自外周血单核细胞(pbmc)的原代人类t淋巴细胞,所述外周血单核细胞分离自从三名人类捐献者的血液。我们发现,ctxd8-car和ctx-car在t细胞上稳定表达。ctxd8-car和ctx-car t细胞的平均表达效率分别为54.4%和51.2%。为了研究ctxd8-和ctx-重定向的car t细胞的效应功能和细胞毒性潜力,我们使用her2 曲妥珠单抗耐药性乳癌衍生细胞系(mda-her2)作为靶标,该细胞表现出高mmp-2表达。我们还研究了对作为已知ctx-car不敏感对照的hek293t细胞系的细胞毒性[wo 2017/066481 a1]。为了评估它们的效应器功能和细胞毒活性,将表达ctxd8和ctx的car t(“效应子”)细胞与mda-her2细胞以不同的效应子与靶细胞比率共培养。通过确定干扰素γ(ifnγ)细胞因子的产生,我们研究了它们的效应功能。ctxd8和ctx衍生的cart细胞产生大量的ifnγ。在未修饰的t细胞(nt)中或在不存在靶抗原(hek293t细胞系)的情况下,没有观察到细胞因子的产生。ctxd8-car或ctx-car效应子处理的肿瘤细胞的活力表示为:肿瘤细胞的平均活力归一化为在用未转导的(“nt”)淋巴细胞共培养物中测量的平均活力的百分比。实施例10和11中描述了研究协议。图9和图10中显示的结果表明,ctx-car和ctxd8-car均诱导显著的细胞毒性作用(活力降低),这取决于效应子与靶的比率。用nt对照t细胞的共培养中没有细胞毒性。然而,ctxd8-和ctx-重编程的car t淋巴细胞均不对hek293t细胞产生细胞毒性作用。我们得出的结论是,ctxd8-car t细胞比ctx-car t细胞诱导更大的细胞毒性。ctxd8-car t细胞的效果具有统计学显著性(双因素anova,随后进行邦费罗尼检验,图10)。
[0275]
关于本发明的ctxd的使用的结论
[0276]
总之,利用设计者毒素和噬菌体展示技术,我们开发了一种新的ctxd先导化合物(即ctxd1),其对mmp-2蛋白的亲和力明显高于ctx和mctx。借助适合于定量评估不同噬菌体展示的ctxd蛋白与mmp-2和与其他潜在靶蛋白的结合强度的新的流式细胞术方法,我们围绕该先导化合物建立了结构-活性关系。这些结构-活性关系研究描绘了一组ctxd化合物,其与ctx和mctx相比,在mmp-2结合方面更有效,并且由于不与nrp1结合而更具选择性。通过使用两种选定的示例氯毒素衍生物ctxd5和ctxd8进行的研究,进一步确认了通过噬菌体展示的蛋白质的研究攻得的观察结果,氯毒素衍生物ctxd5和ctxd8是重组产生的并且用作纯化的测试物质。这些研究与噬菌体展示结果一致,并表明ctxd5和ctxd8的mmp-2亲和力和选择性高3-4倍。令人惊讶的是,ctxd5和ctxd8被证明不仅针对nrp1,而且针对ctx表现出一定程度结合的其他靶蛋白也更具选择性。先导化合物的荧光团-和化疗药物缀合衍生物保留了母体蛋白的mmp-2结合亲和力。此外,荧光团标记的ctxd5和ctxd8以比ctx高得多的强度被肿瘤细胞摄取,并且还表现出与正常细胞相比对肿瘤细胞的选择性增加。此外,所测试的ctxd5化疗缀合物比类似的mctx缀合物以更高的效力抑制胶质母细胞瘤细胞的增殖。以
healthcare),该柱连接至纯色谱系统的。用缓冲液a洗涤后,历经25分钟以2ml/min流速用0-50%线性梯度的20mm tris-hcl ph 8.0、1m nacl(缓冲液b)洗脱dsbc-ctx融合蛋白。在10%三羟甲基甘氨酸-sds凝胶上分析洗脱的级分。合并含有dsbc-ctx的级分,并以2:1融合蛋白:蛋白酶比率补充splb蛋白酶(不可切割的his标记的)和最终浓度为100μm的三(2-羧乙基)膦(tcep)。样品在25℃下温育过夜。次日,在10%三羟甲基甘氨酸-sds page凝胶上测定切割率。向样品中补充nacl和咪唑至终浓度分别为0.5m和15mm,并将溶液通过0.2μm孔径注射过滤器过滤。接下来,使用纯色谱系统以2ml/min将样品施加到8ml biorad nuvia imac树脂上。用20mm tris-hcl ph 8.0、0.5m nacl和15mm咪唑缓冲液洗涤柱并收集流出物。使用20mm tris-hcl ph 8.0、0.5m nacl和250mm咪唑缓冲液从柱上洗脱6xhis-dsbc和6xhis-splb蛋白。使用amicon ultra-15离心过滤器单元(mwco=3000da)浓缩含有靶(rctx)蛋白的流出物。该过滤器单元还用于将洗涤缓冲液更换为10mm tris-hcl ph 8.0、0.5m nacl,以用于随后的尺寸排阻色谱。用10mm tris-hcl ph 8.0、0.5m nacl缓冲液平衡连接到纯色谱系统的hiload 16/600superdex 30pg柱(ge healthcare)。以1ml/min的速度将样品以1ml等份应用至色谱柱。然后,用一柱体积的缓冲液以1ml/min的流速洗脱样品,并在280nm处监测吸光度。在10%三羟甲基甘氨酸-sds凝胶上通过page确定含有氯毒素的级分。通过在amicon ultra-15离心过滤器单元(mwco=3000da)上反复浓缩样品,将含氯毒素的级分的tris-hcl和nacl含量分别降至低于0.01mm和0.5mm,并稀释至经过usp测试的wei水中。在进行冻干之前,通过测量214nm处的吸光度来确定样品的浓度。通过随后的hplc-uv/ms测量确定蛋白质的纯度和分子量。
[0287]
mctx和ctxd的纯化
[0288]
解冻后,向样品中补充终浓度为1mm的苯甲基磺酰氟(pmsf,蛋白酶抑制剂),并通过超声处理破碎细胞。通过以48400
×
g离心20分钟使细胞碎片团粒化,并使用蠕动泵将上清液加载到装有25ml biorad nuvia imac层析树脂的柱上,以捕获6xhis-标记的dsbc-ctx衍生融合蛋白。用5倍柱体积的imac洗涤缓冲液(50mm tris-hcl ph 7.5、300mm nacl和30mm咪唑)洗涤后,用imac洗脱缓冲液(50mm tris-hcl ph 7.5、300mm nacl和250mm咪唑)从柱上洗脱样品。使用spectra/por透析膜(mwco:12000da,fisher scientific)在25℃下针对2升20mm hepes(4-(2-羟乙基)-1-哌嗪乙磺酸)ph 7.5缓冲液对洗脱液进行透析过夜。透析后,向样品中以3:1:1融合蛋白:蛋白酶:tcep摩尔比补充splb蛋白酶和tcep(三(2-羧乙基)膦),并在25℃下温育过夜。次日,在10%三羟甲基甘氨酸-sds page凝胶上检查切割程度。将消化后的样品以20000
×
g离心10分钟,然后通过0.2μm膜过滤,然后在纯系统上进行阳离子交换色谱。将样品加载到用洗涤缓冲液(20mm hepes ph 7.5)预平衡的5ml hiprep sp hp柱(ge healthcare)上,并且用5倍柱体积的洗涤缓冲液洗涤柱。然后,用0-50%线性梯度的洗脱缓冲液(20mm hepes ph 7.5、1m nacl)以2ml/min的流速历经25分钟洗脱样品。在sds-page凝胶上分析洗脱的级分。将含有ctx衍生物的级分合并并且加载到与agilent 1100系列hplc系统(agilent technologies)连接的jupiter 10μc5柱(phenomenex)上。流动相包括含有0.1%甲酸的hplc级水(缓冲液a)和补充有0.1%甲酸的乙腈(缓冲液b)。用15-45%线性梯度的缓冲液b历经30分钟以2ml/min从柱上洗脱蛋白质。在10%三羟甲基甘氨酸-sds凝胶上分析洗脱的级分,并且合并含有ctxd的级分。在进行冻
干之前,通过测量280nm处的吸光度来确定样品的浓度。通过随后的hplc-uv/ms测量来确定蛋白质的纯度和分子量。
[0289]
在实施例2至4中,呈现了缀合的ctx、rctx、mctx、ctxd5和ctxd8的合成。
[0290]
实施例2:荧光团标记的ctx、rctx、mctx、ctxd5和ctxd8的合成
[0291]
花青5标记的ctx以及ctx变体和衍生物的合成
[0292]
使用溶解在0.1m碳酸氢钠(用0.1n hcl调节至ph 8)中的ctx(10mg/ml)与溶解在补充有0.1%(v/v)二异丙基乙胺(dipea)的无水二甲基甲酰胺(dmf)中的花青5n-羟基琥珀酰亚胺酯(cy5-nhs酯,lumiprobe)的混合物,合成了ctx-cy5(单缀合的)。设定染料溶液的浓度,并将两种溶液混合以产生1:0.9的摩尔比(ctx/染料)和1/10的溶剂比(碳酸氢盐/dmf)。缀合在室温下进行1h。使用反相色谱法将反应后的样品纯化至均质。将样品加载到xbridge beh c18柱(3.5μm 4.6
×
50mm)上,该柱连接到配备pda 996检测器的alliance 2795hplc系统。流动相包括含有0.1%甲酸的hplc级水(缓冲液a)和乙腈(缓冲液b)。用5-70%线性梯度的缓冲液b以2ml/min的流速从0.5分钟到4.5分钟从柱上洗脱ctx-cy5,通过收集20秒级分。在650nm处监测吸光度色谱图。在质谱仪(waters acquity sqd;电离:es /es-,源模块温度:150℃,脱溶剂温度:250℃,脱溶剂气体:650l/h,锥孔气体:80l/h,毛细管:3000v,锥孔:30v,提取器:6v,rf透镜:0.1v,扫描:1秒内80至1000m/z,扫描间延迟:0.1s)中分析相对级分样品,并且合并含有纯单缀合的ctx-cy5的级分,并且通过hplc质谱法确认样品的分子量和纯度。最后,将所得样品冻干。通过基本相同的过程合成cy5标记的rctx、mctx、ctxd5和ctxd8。
[0293]
alexa 488标记的ctx以及ctx变体和衍生物的合成
[0294]
还通过类似的过程合成了alexa 488标记的ctx(ctx-a488),不同之处在于起始反应性染料化合物是alexa 488四氟苯基(tfp)酯。
[0295]
实施例3:生物素化ctxd的合成
[0296]
使用溶解在0.1m碳酸氢钠(用0.1n hcl调节至ph 8)中的ctxd(10mg/ml)与溶解在补充有0.1%(v/v)dipea的无水二甲基甲酰胺(dmf)中的生物素3-磺基-n-羟基琥珀酰亚胺酯(sigma)的混合物,合成了生物素化的ctxd(单缀合的)。设定了活化的生物素溶液的浓度,并将两种溶液混合以产生1:1的摩尔比(ctx/生物素)和1:10的溶剂比(碳酸氢盐/dmf)。缀合在室温下进行1h。使用反相色谱法将反应后的样品纯化至均质。将样品加载到与配备pda 996检测器的alliance 2795hplc系统相连的phenomenex jupiter c5柱(4.6
×
250mm)上。流动相包括含有0.1%甲酸的hplc级水(洗脱液a)和乙腈(洗脱液b)。用5-70%线性梯度的洗脱液b在7分钟内以1.8ml/min的流速从5分钟至12分钟从柱上洗脱ctxd-生物素,通过收集27秒级分。在280nm处监测吸光度色谱图。在质谱仪中分析相关级分样品,合并含有纯单缀合的ctxd-生物素的级分,并通过hplc质谱法确认了样品的分子量和纯度。最后,将所得样品冻干。
[0297]
实施例4:ctxd5-戊二酰基-val-cit-pab-mmaf和mctx-戊二酰基-val-cit-pab-mmaf的合成
[0298]
设计了基于ctx受体的靶向化疗药物,包含作为靶向蛋白的ctx衍生物、细胞内切割的组织蛋白酶b酶敏感接头(戊二酰-缬氨酸-瓜氨酸-对氨基苄氧基羰基,简称g-vc-pab)和细胞抑制性单甲基澳瑞他汀f(mmaf)作为有效载荷。为了进行测试,根据以下程序使用
ctxd5或mctx作为靶向分子合成了g-vc-pab-mmaf缀合物:
[0299]
步骤1:vc-pab-mmaf的合成
[0300]
起始材料是购自medchemexpress的fmoc-val-cit-pab-pnp(fmoc=芴基甲氧基羰基保护基团;pnp=对硝基苯基)和mmaf(medchemexpress)。将起始材料(fmoc-val-cit-pab-pnp 28mg和mmaf27mg,摩尔比1.25:1)溶解在含有5.6mg 1-羟基苯并三唑(hobt)和3μl dipea的3.5ml dmf中。室温反应1小时后,加入20%(v/v)哌啶,并且在室温下反应20分钟以除去fmoc保护基团,并且在连接至配备有2487双波长吸光度检测器的waters 600半制备型反相hplc系统的sun fire c18柱(5μm,4.6
×
250mm)上纯化样品。
[0301]
流动相包括含有0.1%甲酸的hplc级水(洗脱液a)和乙腈(洗脱液b)。使用5-70%线性梯度的洗脱液b以13ml/min的流速从5分钟至16分钟从柱上洗脱产物。在280nm处监测吸光度色谱图。在质谱仪中分析相关级分样品,合并仅含有目标化合物(vc-pab-mmaf)的级分并冻干。
[0302]
步骤2:nhs-g-vc-pab-mmaf的合成
[0303]
该反应的起始材料是先前合成的vc-pab-mmaf和购自sigma的二(n-琥珀酰亚胺基)戊二酸酯。将两种起始材料溶解4-4ml二甲基亚砜(dmso)中,前者补充有3μl dipea。然后约半小时内将vc-pab-mmaf溶液滴加到戊二酸二琥珀酰亚胺溶液并反应过夜。次日,如上所述通过hplc纯化目标化合物,冻干并储存在-20℃下直至与ctxd偶联。
[0304]
步骤3:g-vc-pab-mmaf与ctx衍生物的偶联
[0305]
偶联反应以与ctxd5或mctx相同的方式进行。使用溶解在0.1m碳酸氢钠(用0.1n hcl调节至ph 8)中的ctxd5(10mg/ml)与溶解在补充有0.1%(v/v)dipea的无水二甲基甲酰胺(dmf)中的nhs-g-vc-pab-mmaf的混合物进行偶联反应。设定了接头-有效载荷溶液的浓度,并将两种溶液混合以产生1:2的摩尔比(ctxd/接头-有效载荷)和1:10的溶剂比(碳酸氢盐/dmf)。缀合在室温下进行1h。使用反相色谱法将反应后的样品纯化至均质,如上文针对cy5缀合反应所述。由于nhs酯接头-有效载荷分子可以主要与单赖氨酸ctx衍生物中唯一赖氨酸残基的伯胺缀合,其次也可以与n末端胺缀合,因此形成了单缀合物(例如ctxd5-g-vc-pab-mmaf)和双缀合物(ctxd5(-g-vc-pab-mmaf)2)衍生物。因此,在纯化过程中分别收集单缀合物和双缀合物化合物,并在冻干后进行生物学研究。
[0306]
在实施例5至9中,提出了多种测试协议。
[0307]
实施例5:co-珠测试
[0308]
使用co-珠测试来测量噬菌体展示或纯化的ctxd配体蛋白与各种靶蛋白质的结合强度。该测试基于如下原理:将各种his-标记的靶蛋白(受体)锚定到固定化的钴涂覆的his-标签分离和下拉dynabeads(thermofisher scientific,目录号:10104d)上,然后将荧光团标记的配体与靶蛋白结合并通过流式细胞术测量珠结合的荧光强度。
[0309]
co-珠制备
[0310]
将体积为0.5μl的珠子(指定珠子直径1μm)移入每个反应管中,并进行三轮洗涤。每轮洗涤包含将珠子(重新)悬浮在含有0.05%(v/v)tween-20的2ml tris缓冲盐溶液(tbs,来自thermofisher scientific的20x tbs,目录号:28360)中(洗涤溶液以下缩写为tt),将管放入磁力浓缩器(dynamag-5;thermofisher scientific,目录号:12303d)中并且在10分钟后弃去上清液。然后,将珠子在50μl靶蛋白溶液中于4℃下温育过夜。在本技术报
告的研究中,我们以相同的摩尔浓度应用所有靶蛋白:0.16μm,在活性mmp-2(mw 62kda)的情况下相当于10μg/ml。将靶蛋白溶液溶解或稀释在tbs中。同时使用不含靶蛋白的tbs温育阴性对照珠。使用的靶蛋白如下(ncbi登录号[片段氨基酸序列];his标签位置:c末端或n末端;供应商;括号中列出目录号#):mmp2(np_004521.1[110-660];n-;prospec,#enz-769),nrp1(np_001019799.1[1-644];c-;sino biological;#10011-h08h);mmp-9(np_004985.2[20-701];c-;prospec;#enz-1091),timp-2(np_003246.1[27-220];n-;prospec;#enz-646),mmp-14(np_004986[24-524];c-;thermofisher;#rp77533),anx2(np_001002857.1[1-339];n-;prospec;#pro-777),avβ3整合素(aaa52589.1&np_002196.4异二聚体;两者都具有c末端his-标签;native antigen company;#rec31719-100),clc3(np_001820.2[1-818];c-;creative biomart;通过在大肠杆菌中重组表达定制),人类血清白蛋白(np_000468.1[25-609];c-;abcam;#ab217817)。在靶蛋白温育后,将珠子洗涤3次,然后通过用100μl酪蛋白封闭液(sigma,#b6429)在室温下温育1小时进行封闭,然后洗涤三轮。对于噬菌体展示的蛋白质以及对于纯化和标记的蛋白质测试物质,后续过程是不同的。
[0311]
噬菌体展示暴露和染色
[0312]
在测试噬菌体展示蛋白(ctx和ctxd)配体的情况下,将制备的珠子重新悬浮于测试的单克隆噬菌体溶液中并在室温下温育1小时。将噬菌体溶解在噬菌体和抗体温育缓冲液,含有0.5%牛血清白蛋白和0.05%(v/v)tween-20(下文缩写为tbt)的tbs中。噬菌体暴露后,将珠子洗涤3次,然后在含有以1:200稀释的小鼠单克隆抗m13抗体(sino biological,#11973-mm05)的50μl tbt中于4℃下温育30分钟。然后,将珠子洗涤3次,并在含有按1:1000稀释的cy5标记的山羊抗鼠二抗的50μl tbt中于4℃下温育30分钟。经过三轮最终洗涤后,将珠子重新悬浮于2ml tt中,并且准备好进行流式细胞术测量。
[0313]
荧光团标记的测试物质暴露
[0314]
为了测试荧光团标记的测试物质(例如ctx-cy5或ctxd-cy5),将靶蛋白包被的且酪蛋白封闭的珠子重新悬浮于含有指定浓度标记测试物质的50μl测试溶液中,并在室温下温育1小时。例如,通过用tt稀释溶解在含有10-14%(v/v)二甲基亚砜(dmso)的水中的100μm测试物质的储备溶液,以制备测试溶液。用测试溶液温育后,将珠子洗涤3次,重新悬浮于2ml tt中,并且准备好进行流式细胞仪测量。
[0315]
通过流式细胞术测量珠结合的荧光强度
[0316]
使用流式细胞仪(miltenyi biotec的macsquant分析仪10),使用635nm红色激光进行激发,并使用r1通道在脉冲区域模式下进行荧光强度测量,进行流式细胞术分析。每个样品的抽吸体积为200μl,设置为温和混合,并且每个样品采集10000个事件。将流速设置得很慢,最大事件数为每秒500个。在主要珠群周围应用包容性椭圆门,该椭圆门是基于用阴性对照珠获得的前向散点与侧向散点图设置的,以便从分析中排除与双峰和多重峰相关的事件。在使用相同类型的珠子的所有实验中,门控保持恒定。为了定量表征结合,使用门控事件的中值荧光强度(mfi)。结果以mfi或相对荧光强度(rfi)表示,后者定义为样品的mfi与同时处理的相关阴性对照样品的mfi之比。使阴性对照样品经历所有准备、封闭和染色程序,不同之处在于珠子没有包被靶蛋白。为了评估结合强度(即珠结合的噬菌体/蛋白质的数目/量),使用了δmfi或δrfi值,其意指相对于阴性对照样品的值的增加(差)。
[0317]
在评估ctxd展示噬菌体的结合强度期间(例如表i和表ii中呈现的结果),还在同
一实验中以相同的噬菌体浓度(范围为1.08至4.08
×
10
14
个噬菌体颗粒/ml)测试了表达ctx的噬菌体溶液,并且用ctx的δrfi将ctxd的相对mmp-2结合强度(δrfi)标准化(除以)。表i中呈现的相对mmp-2结合强度值是n次实验的平均值。对于mctx和要求保护的化合物(化合物3-18),n为至少3。
[0318]
实施例6:磁珠测试
[0319]
磁珠测试基于以下原理:通过靶蛋白特异性兔igg抗体将靶蛋白锚定到magnabind山羊抗兔igg珠(thermofisher,scientific,目录号:21356),即工厂涂覆山羊抗兔抗体的微珠,并且将荧光团标记的配体结合至靶蛋白,并且通过流式细胞术测量珠结合的荧光强度。使用磁珠测试来表征荧光团标记的ctx、mctx和ctxd配体蛋白与mmp-2和nrp-1靶蛋白的浓度-结合关系,从而通过测量半最大有效浓度(ec
50
值)来表征它们的相对结合亲和力。该方法还有用于通过测量荧光团标记的ctx从mmp-2或nrp1靶蛋白上其受体结合的置换(抑制),来表征未标记的ctxd和缀合的ctx衍生物的相对亲和力。因此,测量了半最大抑制浓度(ic
50
值)以比较各种ctx、mctx和ctxd衍生物的亲和力。
[0320]
磁珠制备
[0321]
将1μl体积的珠子(指定珠子直径1-4μm)移入每个反应管中,并进行三轮洗涤。每轮洗涤包含将珠子(重新)悬浮在2ml dulbecco磷酸盐缓冲盐水(dpbs,sigma#d8662)中,将管放入磁力浓缩器(dynamag-5;thermofisher scientific,目录号:12303d)中,并10分钟后丢弃上清液。然后,将珠子在50μl dpbs中于4℃下温育1小时,该dpbs含有以1:100稀释的针对测试靶蛋白的兔抗体。所使用的抗mmp-2抗体是多克隆抗体(thermofisher scientific,目录号:pa1-16667),其是针对660个氨基酸长的人类mmp-2蛋白(np_004521.1)中氨基酸位置504-518处的合成序列而产生的。mmp-2蛋白可以是具有非常相似ctx结合结果的成熟活性酶(例如,prospecbio#enz-100或sigma#srp3118)或酶原(例如prospecbio#enz-769或sigma#srp6270)。所使用的抗nrp1抗体是多克隆抗体(thermofisher scientific,目录号:pa5-26079),其是针对923个氨基酸长的人类nrp1蛋白(np_003864.5)中氨基酸位置722-750处的合成序列而产生的。将通过抗体锚定到珠子上的nrp1蛋白重组地产生为单一糖基化多肽链,其含有923个氨基酸长的序列(prospec,目录号:cyt-1059)中的843个氨基酸(22-856)。在二抗包被后,将珠子洗涤3次,并在含有浓度为0.16μm的所选靶蛋白(例如mmp-2或nrp1)的50μl dpbs中在室温下温育1小时。在磁珠测试中,无需应用任何封闭温育来消除非特异性结合。
[0322]
测试物质暴露
[0323]
用于测试荧光团标记的测试物质(例如ctx-cy5或ctxd-cy5或ctx-a488),将靶蛋白包被的珠子重新悬浮于含有指定浓度标记测试物质的测试溶液中,并在室温下温育1小时。例如,通过用dpbs稀释溶解在含有10-14%(v/v)二甲基亚砜(dmso)的水中的100μm测试物质的储备溶液,来制备测试溶液。用测试溶液一起温育后,将珠子洗涤3次,重新悬于2ml dpbs中,并且准备好进行流式细胞述测量。
[0324]
为了测试未标记的测试物质,将靶蛋白包被的珠子重新悬浮于50μl测试溶液中并且在室温下温育1小时,该测试溶液含有指定浓度溶解在dpbs中的未标记的测试物质。然后,加入含有2μm标记的ctx(ctx-cy5或ctx-a488)和指定浓度未标记测试物质的50μl dpbs溶液,以在1μm标记的ctx(置换的指示配体)和指定浓度未标记的测试物质(置换配体)中温
育珠子。将珠子在室温下再温育1小时,然后洗涤3次,重新悬浮于2ml dpbs中,并且准备好进行流式细胞术测量。
[0325]
通过流式细胞术测量珠结合的荧光强度
[0326]
使用流式细胞仪(miltenyi biotec的macsquant analyzer 10),在脉冲区域模式下,使用635nm红色激光进行激发并且使用r1通道进行cy5标记的配体结合的荧光强度测量,或使用488nm蓝色激光进行激发并使用bl荧光强度通道进行a488标记的配体结合的测量,进行流式细胞术分析。每个样品的抽吸体积为200μl,设置为温和混合,并且每个样品采集10000个事件。流速设置得较慢,最大事件数为每秒500个。在主要珠群周围应用包容性椭圆门,该椭圆门是基于用阴性对照珠获得的前向散点与侧向散点图设置的,以便从分析中排除与双峰和多重峰相关的事件。在使用相同类型的珠子的所有实验中,门控保持恒定。
[0327]
为了定量表征标记配体的结合,使用了门控事件的mfi。结果以δrfi(rfi减一)值表示。通过绘制δrfi值相对于对数浓度的图并通过s形曲线拟合(玻尔兹曼函数)确定半最大有效浓度(ec
50
)来评估标记的测试物质的相对亲和力。
[0328]
在置换研究中,将结果转化为标记配体结合的抑制百分比(置换%),并通过绘制百分比置换相对于浓度对数的图并通过s形曲线拟合确定半最大抑制浓度(ic
50
)来评估未标记测试物质的相对亲和力。
[0329]
实施例7:用于噬菌体展示的配体肽结合测量的噬菌体的制备
[0330]
噬菌体展示测试溶液是根据常规噬菌体展示协议[例如tonikian 2007]制备的。将编码表达的肽的磷酸化且退火的寡核苷酸以1:3的载体/插入物段比率连接至pas62噬菌粒载体[us8716437b2,第32列,第48至49行]。具有插入物的噬菌粒编码展示的蛋白质,其c末端延伸有与p3外壳蛋白融合的接头肽序列(gsassa)。用连接产物转化电感受态细菌细胞(大肠杆菌ss320),然后划线到含有氨苄青霉素(100μg/ml)的溶源肉汤琼脂(lb/amp)平板上,并在37℃下温育16小时。在这些条件下,只有携带噬菌粒的细胞才能存活并形成集落。对一些克隆进行了测序,并将具有已确认靶序列的单集落接种到3ml 2yt/amp肉汤中,并在37℃下温育直至培养物达到对数中期。培养物用m13ko7辅助噬菌体(噬菌体/细胞比10:1)感染,并在37℃下温育30分钟。将3ml培养物转移至200ml2yt/amp/kan肉汤中并温育过夜。将过夜细胞培养物(200ml)在400ml离心管中于4℃下以8000x g离心10分钟团粒化。将上清液转移至装有40ml peg/nacl(200g/l peg-8000、146.1g/l nacl)的新鲜400ml离心管中,充分混匀,并且在室温下温育20min。通过在室温下以18000x g离心15分钟来团粒化沉淀的噬菌体。弃去上清液后,管再次以1000rpm离心1分钟,团粒面向切向侧以收集并除去残留液体。将噬菌体溶解在4ml噬菌体重悬缓冲液(tbt)中,并通过在4℃下以18000x g离心10分钟去除所有不溶物质。将上清液转移至四个1.5ml离心管(4x1 ml)中,并用200-200μl peg/nacl再次沉淀,并再温育5分钟,然后再次以12000x g离心。将团粒重悬于低体积(150-300μl)噬菌体重悬缓冲液中,并合并成单一噬菌体溶液。使用nanodrop one c(thermo scientific)分光光度计,基于吸光度(od268)与噬菌体滴度在0.5-10吸光度范围内的线性关系,确定了噬菌体溶液的颗粒浓度。根据以下公式评估噬菌体颗粒浓度:(od
268-od
320
)
×5×
10
12
个颗粒/ml[tonikian 2007];并用tbt稀释至目标浓度。
[0331]
实施例8:通过流式细胞术分析荧光团标记的测试物质的细胞染色强度
[0332]
除非另有说明,将细胞在37℃下在含有5% co2的潮湿气氛中维持在推荐培养基
中,该培养基补充有10%胎牛血清(fbs)和抗生素抗真菌溶液(ab/am,sigma#a5955)。所使用的细胞(括号中的来源#目录号和培养基)如下:u251 mg人类胶质母细胞瘤(sigma#09063001,rpmi-1640),u87mg人类胶质母细胞瘤(sigma#89081402,dmem高葡萄糖),panc-1人类胰癌(sigma#87092802,dmem高葡萄糖 glutamax),a375人类黑色素瘤(sigma#88113005,dmem高葡萄糖 glutamax),sk-br-3人类乳癌(addexbio#c0006007,dmem低葡萄糖),te-671人类横纹肌肉瘤(sigma#85111502,dmem高葡萄糖),hdfa人类真皮成纤维细胞(sigma#106-05a,不含任何其他补充剂的成纤维细胞生长培养基),huvec人类内皮细胞(thermofisher#c0035c,仅添加大血管内皮补充剂的培养基200),新生大鼠星形胶质细胞(thermofisher scientific#n7745100,dmem高葡萄糖 glutamax,补充有15% fbs)。
[0333]
除去培养基后,通过应用tryple表达细胞解离酶溶液5至10分钟来分离细胞,然后通过添加含fbs的培养基灭活酶。离心洗涤细胞3次,弃去上清,并且重悬于dpbs中。第三次洗涤后,通过countess ii自动细胞计数仪(thermofisher scientific)从20μl样品中确定悬浮液的细胞密度,并且还通过用0.4%台盼蓝复染来评估是否满足存活率》95%的标准。通过用dpbs稀释将细胞密度设定在每毫升100-150万个细胞之间。将细胞悬浮液作为100μl样品分配到5ml流式细胞术管中,并以1-3μl体积加入标记的测试物质(例如根据需要稀释的100μm储备溶液)或等效载体(例如10% dmso溶液)。将管在37℃、含有5% co2的潮湿气氛中温育45分钟。然后,将试管置于冷藏架中,并且将细胞在4℃下温育15分钟,并在每个试管中添加2.5μm po-pro-1以对非活细胞进行染色。然后,将细胞洗涤3次,重悬于冷dpbs(2ml/管)中,并保存在冷藏架中直至进行流式细胞术测试,尽快进行,通常在一小时内。
[0334]
使用流式细胞仪(miltenyi biotec的macsquant analyzer 10),使用635nm红色激光进行激发并且使用r1通道进行cy5标记配体摄取的荧光强度测量,并且使用405nm紫色激光进行激发并使用v1通道进行po-pro-1荧光检测,进行流式细胞述分析。来自两个通道的事件均以脉冲区域模式记录。每个样品的抽吸体积为200μl,设置为温和混合,并且每个样品采集10000个事件。流速设置得很慢,最大事件数为每秒500个。
[0335]
为了分析每组实验,首先在使用未染色的对照细胞获得的线性模式esc与ssc散点图上定义门控,以便在分析中仅包括具有细胞系典型大小和粒度的单个细胞。显示高po-pro-1信号强度的非活细胞也被排除在分析之外。在使用相同类型细胞的所有实验中,所建立的门控设置保持不变。为了定量表征染色强度,使用了门控事件的中值荧光强度(mfi)。结果以mfi或相对荧光强度(rfi)表示,后者定义为样品的mfi与同时处理的未染色载体对照样品的mfi之比。为了评估细胞摄取,使用了δmfi或δrfi值,其意指相对于同时未染色的对照样品的值的增加(差)。大多数实验以重复的形式进行。
[0336]
实施例9:测试物质的细胞抑制效力的测量
[0337]
细胞以单层形式生长,并在37℃、含有5% co2的潮湿气氛中温育,直至它们达到75-90%的汇合水平。通过tryple表达分离后,将细胞以1,500个细胞/孔接种到96孔板中,每孔100μl细胞培养基中补充有10%fbs。经过大约24小时温育期后,将每孔中的全部培养基替换为90μl新鲜培养基,向其中添加30μl含有测试物质的培养基,以在3.16倍步长中产生3.16nm到3.16μm的各种测试浓度。然后,将细胞再温育72小时。使用细胞计数试剂盒-8(cck-8)活力测定,根据制造商的说明确定了用测试物质处理后的细胞活力。简而言之,将cck-8溶液添加到细胞中以构成10%培养物体积。将细胞在37℃下再温育4小时,并使用读
板器通过460nm处的吸光度测量甲臜染料的产量。所有实验均以六次平行测量进行。
[0338]
对于每次处理,在同一板上同时运行载体对照组。将每种处理的结果计算为相应载体组的%,并根据玻尔兹曼函数用s形曲线拟合以对数标度对浓度进行绘图。在拐点处确定百分之五十的抑制浓度(ic
50
),即在载体对照和最大抑制之间的中间位置。将最低有效浓度定义为产生大于百分之二十且具有统计显著性抑制的最低测试浓度。与载体对照的统计显著性差异通过单因素anova和随后的dunnett检验进行检验。
[0339]
实施例10:生成ctx-car/ctxd-car t细胞
[0340]
转导载体的构建
[0341]
我们设计了ctxd8-car和ctx-car基因盒,其含有编码以下蛋白质结构域序列的cdna:igg重链信号肽(gmcsfra)、ctxd8或ctx、cd8α铰链、具有cd28细胞内共刺激内结构域的人类cd28跨膜区(cd28跨膜和cd28细胞质)、(gly)3接头、人类cd3ζ的细胞质区域、t2a自切割肽和截短的cd19。设计的ctxd8-car构建体的氨基酸序列如图11所示并在seq id no:44中列出。图11描绘了氨基酸序列的上述元件,其中gmcsfra信号肽、cd8α铰链、cd28细胞质、cd3ζ和截短的cd19加了下划线。添加无功能的截短cd19以检测转导效率。该盒是插入puc57克隆载体中获得的,然后切下并连接到修饰的pmsgv逆转录病毒载体中。使用jetprime转染试剂(polyplus,illkirch,france),通过用ctxd8-和ctx-car-编码修饰的msgv逆转录病毒载体、含有momlv gag-pol序列的peg-pam-e质粒和含有rd114序列的pmax.rd114质粒瞬时转染hek 293t细胞,生成了编码ctxd8-car或ctx-car的逆转录病毒颗粒。转染后72小时收集病毒上清液,并在同一天用于t细胞转导、或速冻并储存在-80℃下直至使用。
[0342]
t淋巴细胞的增殖和转导
[0343]
使用-1077(sigma-aldrich(st.louis,mo,usa))通过密度梯度分离,从健康供体中分离了外周血单核细胞(pbmc)。然后,将细胞接种于预涂有1μg/ml抗cd3e(克隆:okt3;thermo fischer,waltham,ma,usa)和抗cd28(r&d systems,minneapolis,mn,usa)的24孔非组织培养处理的板中。用于初始刺激的培养基是补充有10%胎牛血清和2mmol/l glutamax(thermo fisher,waltham,ma)的rpmi 1640。24小时后,将人类白细胞介素-7(il-7;10ng/ml)和人类白细胞介素-15(il-15;5ng/ml)(miltenyi biotec,bergisch gladbach,germany)添加到培养物中。次日,在存在il-7(10ng/ml)和il-15(5ng/ml)的情况下,在20μg/ml retronectin(takara bio,mountain view,ca)包被的板上用逆转录病毒颗粒转导细胞。温育48小时后,将细胞用于进一步实验。
[0344]
转导效率的评估
[0345]
逆转录病毒转导的效率通过使用别藻蓝蛋白缀合的抗人类cd19抗体(beckman coulter,brea,ca),通过流式细胞述检测截短的cd19分子确定了逆转录病毒转导的效率。通过alexa fluor 488缀合的抗人类cd3抗体(bd biosciences,san jose,ca,usa)染色确定t细胞纯度。用于流式细胞术分析的所有抗体均以10μg/ml终浓度在冰上放置10分钟。使用novocyte流式细胞仪和novoexpress软件(acea biosciences,san diego,ca,usa)对每个样品的至少10,000个细胞进行分析。
[0346]
实施例11:ctx-car/ctxd-car t细胞的细胞毒性潜力的研究
[0347]
用编码人类her2基因的慢病毒颗粒转导her2阴性mda-mb-468细胞系(购自美国典
型培养物保藏中心(manassas,va,usa))后,通过该her2阴性mda-mb-468细胞系的单细胞克隆,产生了her2 曲妥珠单抗抗性乳癌衍生细胞系(mda her2)。hek293t阴性对照细胞系购自美国典型培养物保藏中心(manassas,va,usa)。在用编码egfp.ffluc的逆转录病毒转导mda-her2和hek293t细胞系以表达增强型绿色荧光蛋白(egfp)和萤火虫荧光素酶(ffluc)融合基因之后,通过该mda-her2和hek293t细胞系的单细胞克隆,产生了萤火虫荧光素酶的mda-her2和hek293t细胞系。
[0348]
通过基于荧光素酶的细胞毒性测定,确定了car t细胞针对靶的细胞毒性活性。将表达egfp/ffluc的mda-her2和hek293t细胞以105个细胞/孔的密度接种在96孔平底板中,一式两份。4小时后,将不同量的ctxd8-和ctx-衍生的car t细胞添加到肿瘤细胞中,以评估一系列效应细胞与靶细胞比率下的细胞毒性。将具有未修饰的效应细胞(nt)的孔用作未处理的对照参考。24小时后,除去培养基和t细胞,并通过荧光素酶活性对剩余的肿瘤细胞进行定量。根据制造商的说明(promega,madison,wi,usa)使用荧光素酶测定试剂盒并通过synergy ht光度计(biotek,winooski,ve,usa)进行检测。
[0349]
参考文献
[0350]
专利文献
[0351]
us20100215575 a1(transmolecular inc)2010年8月26日
[0352]
us20100210546 a1(transmolecular inc)2010年8月19日
[0353]
wo 2011094671 a2(the uab research foundation)2011年8月4日
[0354]
wo 2011142858 a2(fred hutchinson cancer research center)2011年11月17日
[0355]
wo 2015042202 a1(blaze bioscience inc)2015年3月26日
[0356]
wo 2017066481 a1(city of hope)2017年4月20日
[0357]
wo 2017136769 a1(eisai r&d management co ltd)2017年8月10日
[0358]
us 8716437 b2(steven a.goldstein,zoltan takacs)2011年1月13日
[0359]
非专利文献
[0360]
akcan,m.et al.chemical re-engineering of chlorotoxin improves bioconjugation properties for tumor imaging and targeted therapy.,j.med.chem.2011.vol.54,no.3,pages 782 to 787.
[0361]
cheng,y.et al.recent advances in diagnosis and treatment of gliomas using chlorotoxin-based bioconugates,am.j.nucl.med.mol.imaging 2014.vol.4,no.5,pages 385 to 405.
[0362]
cohen,g.et al.chlorotoxin-a multimodal imaging platform for targeting glioma tumors.toxins(basel)2018.vol.10,no.496.pages 1 to 12.
[0363]
dardevet,l.et al.chlorotoxin:a helpful natural scorpion peptide to diagnose glioma and fight tumor invasion.toxins.(basel)2015.vol.7,no.4,pages 1079 to 1101.
[0364]
debin,j.a.et al.purification and characterization of chlorotoxin,a chloride channel ligand from the venom of the scorpion.am.j.physiol 1993.vol.264,no.2,pages c361 to c369.
imaging study of tozuleristide(blz-100)in adults with newly diagnosed or recurrent gliomas.neurosurgery 2019.vol.85,no.4,pages e641 to e649.
[0382]
smith,g.p.filamentous fusion phage:novel expression vectors that display cloned antigens on the virion surface.science 1985.vol.228,no.4705,pages 1315 to 1317.
[0383]
soroceanu,l.et al.use of chlorotoxin for targeting of primary brain tumors.cancer res.1998.vol.58,no.21,pages 4871 to 4879.
[0384]
soroceanu,l.et al.modulation of glioma cell migration and invasion using cl(-)and k( )ion channel blockers.j.neurosci.1999.vol.19,no.14,pages 5942 to 5954.
[0385]
stroud,m.r.et al.in vivo bio-imaging using chlorotoxin-based conjugates.curr.pharm.des.2011.vol.17,no.38,pages 4362 to 4371.
[0386]
trevino,s.r.et al.amino acid contribution to protein solubility:asp,glu,and ser contribute more favorably than the other hydrophilic amino acids in rnase sa.j.mol.biol.2007.vol.366,no.2,pages 449 to 460.
[0387]
takacs,z.et al.a designer ligand specific for kv1.3 channels from a scorpion neurotoxin-based library.proc.natl.acad.sci.u.s.a.2009.vol.106,no.52,pages 22211 to 22216.
[0388]
tonikian,r.et al.identifying specificity profiles for peptide recognition modules from phage-displayed peptide libraries.nat.protoc.2007.vol.2,no.6,pages 1368 to 1386.
[0389]
veiseh,m.et al.tumor paint:a chlorotoxin:cy5.5 bioconjugate for intraoperative visualization of cancer foci.cancer res 2007.vol.67,no.14,pages 6882 to 6888.
[0390]
wiranowska,m.et al.clathrin-mediated entry and cellular localization of chlorotoxin in human glioma.cancer cell int.2011.vol.11,no.27,pages 1 to 13.
[0391]
yosef,g.et al.targeting the mmp-14/mmp-2/integrin alphavbeta3 axis with multispecific n-timp2-based antagonists for cancer therapy.j.biol.chem.2018.vol.293,no.34,pages 13310 to 13326.
[0392]
zhang,h.p.et al.engineering better chimeric antigen receptor t cells.exp.hematol.oncol.2020.vol.9,no.1,34.
[0393]
zhong,x.s.et al.chimeric antigen receptors combining 4-1bb and cd28 signaling domains augment pi3kinase/akt/bc1-xl activation and cd8 t cell-mediated tumor eradication.mol.ther.2010.vol.18,no.2,pages 413 to 420。
[0394]
[0395]
[0396]
[0397]
[0398]
[0399]
[0400]
[0401]
[0402]
[0403]
[0404]
[0405]
[0406]
[0407]
[0408]
[0409]
[0410]
[0411]
[0412]
[0413]
当前第1页1
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!